Weekly COVID-19 Review 20200424
이번주에도 지난주처럼 remdesivir 뉴스에 시장 전체가 흔들렸습니다. 아마도 다음주에도 비슷한 현상이 반복되지 않을까 싶습니다. 어느 방향이 될지는 두고봐야겠지요.
지난주 Weekly COVID-19 Review
Weekly COVID-19 Review 20200417
이번주도 그동안 한번도 못들어본 바이오텍들이 COVID-19 관련 의약품/진단법 개발 뉴스들을 쏟아 냈습니다. 모두 정리하지는 못했는데, 상당수 회사들이 OTC에 상장된 그야말로 X잡주들입니다. 하지만 이번주 가..
woojkim71.tistory.com
※ 리뷰 내용중 사실관계가 잘못됐거나, 해석의 오류가 있거나, 간단히 제시한 필자 의견에 이견이 있거나, 혹은 잘 이해가 안가거나, 궁금한 내용이나 제안이 있으신 분들은 언제든 댓글로 알려주시기 바랍니다.
진단
백악관 TF팀에서 항체검사와 비즈니스 오프닝을 연관지어 언급한 이후로 확실히 핵산 진단보다는 항체 진단에 대한 뉴스들이 많습니다. 이번주에는 샌프란시스코, LA, 뉴욕, 보스톤 등지에서 무작위로 실시한 항체 검사를 통해 실제 감염자가 10배에서 많게는 50배까지도 있을 수 있다는 뉴스가 연이어 나왔습니다. 핵산 진단 테스트는 이미 충분히 많은 기업들이 이미 개발, 판매를 하고 있어서 최근에는 뉴스가 뜸한데 주로 샘플 채취가 용이한 침을 이용한 분석이나 가정에서 할 수 있는 테스트들이 뉴스 플로우를 장식하고 있습니다.
※ FDA는 3/16에 EUA (긴급사용승인)를 받기 전이라도 validation된 테스트들은 시중에 유통할 수 있다고 발표했음. Valdiation이란 GLP, CLIA 등의 보증된 랩 (certified lab)에서 진단 키트가 정해진 기간, 정해진 환경에서 반복적으로 동일한 결과를 낼 수 있음을 검증하는 과정이라고 이해하면 됨.
[핵산 진단]
LabCorp (LH): FDA에서 가정용 Pixel COVID-19 진단을 EUA 승인. 집으로 샘플 채취에 사용되는 스왑을 보내 샘플을 채취해서 보내면 랩에서 검사를 돌리는 방식. 들은 바로는 코를 통해 샘플채취하는 것이 쉽지 않다고 하던데 과연 가정에서 각자 하라면 샘플 채취가 제대로 될지 의문스러움. 진단쪽에 종사하고 있는 지인이 보낸 카톡 메시지 첨부.
"집에서 self-test가 처음 FDA승인을 받았다는 기사를 보고 (주가도 오름) 살펴봤더니 코메디. 사연인즉, 1. $120를 내면 FedEx priority 배송으로 swaps 도구를 집으로 배송해줌. 2. 혼자서 swaps 채취후 봉투에 넣어서 LabCorp본사로 발송하면 본사에서 RT-PCR돌려서 회사 홈페이지를 통해서 음성/양성 여부를 알려주는 비지니스. $120중에 $100은 배송비 일것임. 이따위도 FDA가 승인을 해주네. 치떨어지게시리."
사실 그동안 코로나-19 진단, 치료제 관련 뉴스들 중에 코미디가 한둘이 아니었음.
FDA 승인 RNA 진단법 민감도 비교
FDA의 EUA를 받은 진단법들의 LOD를 비교. * LOD: limits of detection. 95%의 확률로 테스트가 검출할 수 있는 가장 낮은 농도. 각 진단법들은 세가지 중의 하나로 LOD를 표기하고 있음. copies per mL: 1 mL 당..
woojkim71.tistory.com
[항체 진단]
FDA, NIH, CDC: 트럼프 행정부에서 비즈니스 오픈을 압박하고 있는 반면 의료전문가들은 조심스러운 관점을 보이는 가운데, FDA, NIH, CDC 세 기관이 공동으로 현재 마켓에 나와있는 항체 진단 및 개발중인 진단까지 퍼포먼스 테스트 및 validation을 하기로 함. FDA가 제시한 자세한 사항은 아래 링크에.
Coronavirus (COVID-19) Update: Serological Test Validation and Education Efforts
FDA provides details about its thinking on antibody tests for COVID-19 and the agency’s approach to making accurate and reliable serology tests widely available
www.fda.gov
이번주에도 전임 FDA 수장 Scott Gottlieb, 로슈 사장님 Severin Schwan 등이 시중에 유통중인 항체 진단에 대해 비판적인 시각을 표출한 바 있음. 가장 문제가 되는건 위양성 (false positive)로 실제로는 항체가 없는데 있다고 나온 사람들의 경우 감염 위험에 빠질 수 있음. Evaluate Pharma에 의하면 현재 10여종의 항체 진단이 시중에 나와있고 이중 세개 (별표)가 FDA로부터 EUA 승인을 받았음.

NovaBay Pharmaceuticals (NBY): 중국 Shenzhen Microprofit Biotech의 SARS-CoV-2 IgG & IgM Antibody Combined Test Kit의 미국내 배급에 대한 계약을 맺음. 키트는 ISO 13485와 CE Mark 인증된 제품. NovaBay는 FDA에 EUA와 510(k) 신청 예정.
Quest Diagnostics Inc (DGX), Abbott Laboratories (ABT), PerkinElmer Inc. (PKI): Abbott, PerkinElmer, Euroimmun에서 제조한 진단 키트/장비를 이용해서 항체 검사를 시작한다고 발표. Quest는 LabCorp과 함께 미국의 양대 레퍼런스 랩. 미국 시스템에 익숙치 않은 분들을 위해 부연설명하자면, 한국은 병원에 가면 큰 병원이면 병원 내에 있는 채혈실로 가서, 작은 병원이면 병원에서 직접 피를 뽑아서 어디론가 샘플을 보내 병원에서 진단 결과를 알려주는 시스템. 따라서 한국분들은 레퍼런스랩에 익숙치 않을 듯. 미국은 주치의 시스템이고 대부분의 의료활동은 동네 소규모 병원을 통해 이루어짐. 병원을 방문하면 테스트가 필요한 경우 레퍼런스랩으로 보냄. 환자는 레퍼런스랩을 직접 방문해서 그곳에서 피를 뽑고 결과는 병원을 통해 통보 받는 시스템. 따라서 미국인들은 레퍼런스랩을 보통 1년에 한번은 방문하게 됨 (정기검진을 위해). LabCorp과 Quest는 전국적인 망을 갖춘 미국내 양대 레퍼런스랩임.
Enzo Biochem (ENZ): 바이러스 핵산 검사, IgG/IgM 핵산 검사, 싸이토카인 검사와 치료제 후보물질 (SK1-I)를 종합한 포괄적인 Covid-19 프로그램을 발표. 현재 GENFLEX 플랫폼을 이용한 바이러스 핵산 검사를 EUA 승인을 받아 제공중.
Aytu BioScience (AYTU): 싱가폴 Biolidics Limited의 COVID-19 IgG/IgM Rapid Test의 미국내 배급 계약 체결. 테스트는 싱가폴 보건당국의 승인을 받은 제품.
FDA의 EUA를 받은 진단법 리스트
Emergency Use Authorizations
This page lists current Emergency Use Authorizations that make available medical devices to diagnose and respond to public health emergencies.
www.fda.gov
항바이러스 치료제
[Remdesivir]
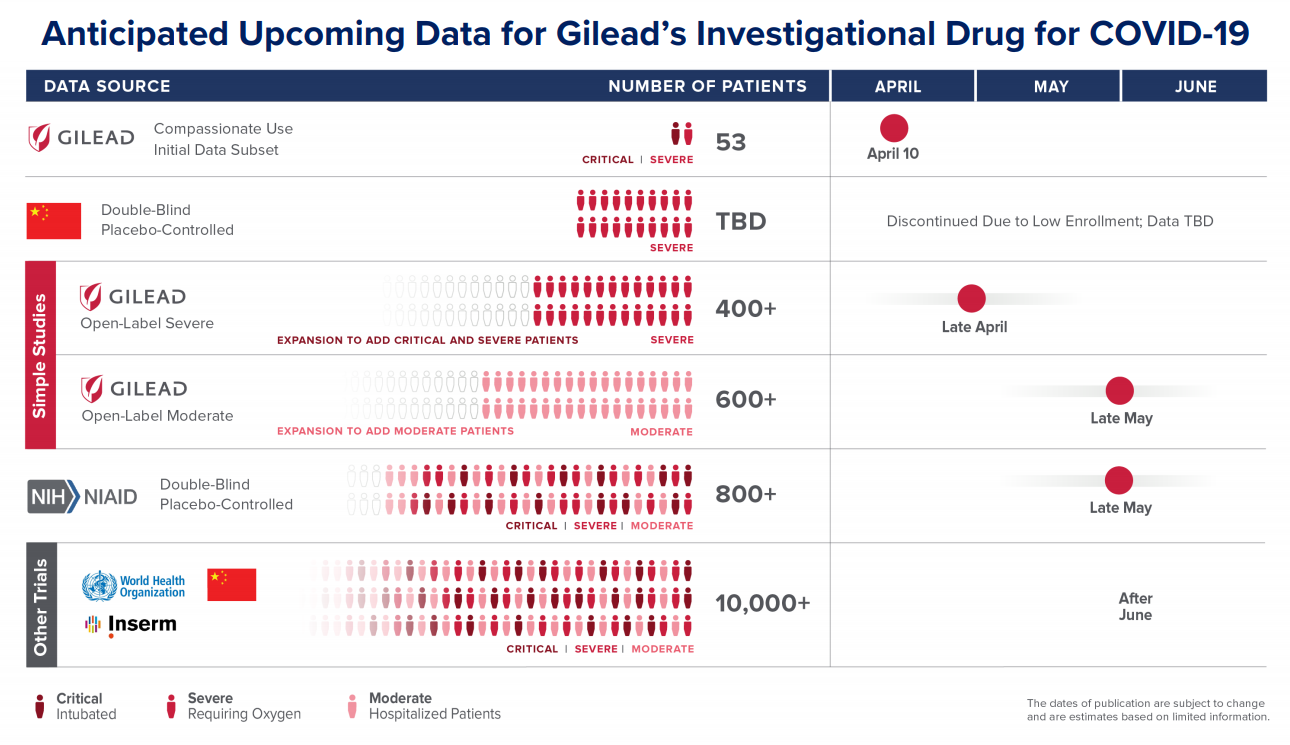
Gilead Sciences (GILD): (목요일) WHO 웹사이트에 중단된 중국에서의 remdesivir 임상시험 결과 서머리가 실수로 올라왔다가 내려갔다고 FT가 보도. 임상 결과는 현재 학술지 게재를 위해 심사중. 서머리에 의하면 287명의 중증환자 대상 임상시험에서 투여군과 표준치료군의 사망률이 13.9%대 12.8%로 통계적 유의미성을 보이지 않았고 바이러스 양도 감소시키지 못한 반면, 부작용으로 인한 임상 중단은 11.6%대 5.1%로 오히려 두배 가량 높은 등 remdesivir의 임상적 유용성이 없다고 언급. 이에 대해 Gilead의 대변인 Amy Flood는 환자모집의 어려움으로 인해 중단된 임상시험이라 환자수가 통계처리하기에 부족한 결과이고 데이타에 의하면 초기에 투여할 수록 효과를 보인다고 주장. 원래 모집 계획은 453명. 중국 임상시험의 환자들은 증상 발병후 12일 이내, 길싸 자체 임상시험의 환자는 확진 후 4일 이내가 모집 기준. 더불어 길싸 환자군에는 아주 심각한 환자들인 기계 산소 공급기를 5일 이상 사용한 환자들은 제외됨. 따라서 길싸 환자들이 중국 환자들 보다 좀 더 경미한 중증이고, remdesivir를 좀 더 일찍 투여받게 되므로 길싸의 설명도 말은 됨. 길싸가 모집 환자수를 대폭 늘린데에는 아마도 remdesivir가 특정 환자군, 특정 발병 시간대에 더 효과적이기 때문인 듯이라고 짐작됨. 이런 경우 ‘무조건 잘 듣는’ 약은 아니게 됨. 길싸 스터디가 ‘통계적 유의미성 확보’는 가능하지만 시장 반응은 뜨뜻 미지근하지 않을까하는 뇌피셜.
(금요일) NIAID에서 진행중인 입원환자에 대한 placebo controlled, randomized 임상 3상의 모집 인원을 약 두배 가량인 572명으로 증원됐다고 보도. Primary endpoint는 29일차까지 회복되기까지 걸리는 일수. 회복의 기준은 입원했지만 산소호흡기가 필요없거나 더이상의 치료가 필요 없는 경우, 퇴원해서 가정용 산소공급장치를 사용하고 있거나 완치된 경우 등. 이 보도가 나온 후 블룸버그는 이 임상시험은 이미 환자수 모집 타겟을 충족해서 모집 종료됐고 이르면 예정보다 빠른 5월 중순에 결과가 발표된다고 보도.
현재 remdesivir의 진행중인 임상시험은 총 5개 (중국에서 중단된 두개 제외): 길싸 자체 두개, 위에 언급한 NIAID, 그리고 WHO에서 배스킷 (여러 치료제 후보물질을 한데 묶어서 진행중)으로 진행하는 임상시험과 유럽의 Inserm에서 진행하는 것까지. 이중 아래 길싸에서 제공한 표에서 보듯 길싸 자체 임상시험은 4월말과 5월말에, NIAID는 예정됐던 5월말보다 빠른 중순에 결과가 나올 수 있을 것으로 보임. 이에따라 시장 변동성이 발생할 듯.
[Chloroquine]
클로로퀸/하이드록시클로로퀸에 대해서는 초기에만 좋은 뉴스가 나왔고 점점 안좋은 뉴스만 나오는듯 합니다. 임상시험에서 부작용으로 인해 오히려 복용시 사망률이 더 높다는 보고와 함께 조기 중단되는 사례가 계속 나오는 가운데 결국 FDA에서 금요일 심박에 문제가 생길 수 있다면서 병원과 임상시험에서의 사용 이외에는 개인적으로 복용하지 말것을 경고했습니다. 또 트럼프가 클로로퀸 사용을 밀어붙이면서 BARDA의 수장과 트러블이 생겨서 그가 물러나게 됐다는 보도도 있었습니다.
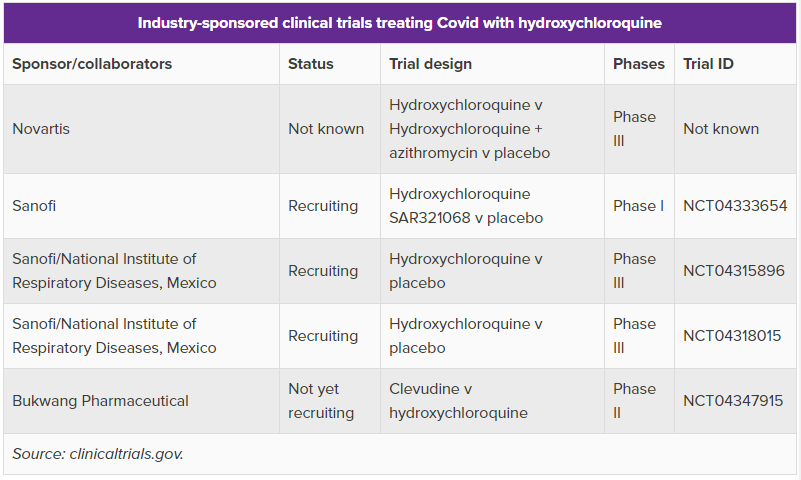
Novartis (NVS): 클로로퀸에 대한 임상시험 대부분이 소규모로 결과의 신빙성에 의문이 제기되는 가운데 노바티스가 440명의 입원 환자를 대상으로 하는 randomized 임상 3상 계획을 발표. 아래 표는 Evaluate Pharma에서 정리한 상장기업에서 진행중인 하이드록시클로로퀸 임상시험들. 현재 진행중인 대부분의 임상시험이 아카데미 기관들의 스폰서. 제약회사 스폰서는 아래 다섯개. 노바티스 외 사노피 셋, 부광약품 하나. 부광약품의 의도는 모르겠고, 클로로퀸/하이드록시클로로퀸은 돈벌 수 있는 약이 아니기 대문에 사노피나 노바티스는 릴리 사장님이 컨콜에서 언급했듯 아마도 레퓨테이션 때문에 시작한 듯. 그동안 제약업계를 비난만 해오던 각국 정치권이 현재는 제약업계에 목매달고 있는 상황.
클로로퀸 time line (수정: 프랑스 결과)
지난주 트럼프 대통령이 클로로퀸에 대해 언급하면서 여러가지 오해들이 생긴듯 합니다. 클로로퀸에 대해 코로나-19에 대해 서구 전문지들에 언급된 내용들을 시간순으로 정리해봤습니다. 정리해보면 중국에서 in..
woojkim71.tistory.com
[기타 항바이러스제]
Anixa Biosciences (ANIX): 항암제 개발 업체. 독일의 OntoChem GmbH과 공동으로 프로티에이즈 Mpro와 endoribonuclease를 타겟팅하는 항바이러스제를 개발한다고 발표.
ChromaDex (CDXC): 학술지 bioRxiv 온라인판에 게제된 논문에서 세포와 동물 실험 결과 바이러스 감염이 세포내 NAD와 PARP 유전자 발현을 감소시킨다고 발표.
Cerus (CERS): BARDA와의 기존 협약을 수정해서 INTERCEPT RBCs과 INTERCEPT Blood System의 Covid-19 적용을 목표로 한 개발 비용으로 추가적인 $14M을 지원받는다고 발표. 총 지원규모는 $214M가 됨. INTERCEPT Blood System은 수혈시 병원균 감염을 막기 위해 병원균을 살균해주는 시스템.
BioSig Technologies (BSGM): 자회사 ViralClear의 merimepodib과 Gilead Sciences의 remdesivir를 SARS-CoV-2가 감염된 배양세포에서 비교한 결과 두 약물 모두 바이러스 증폭을 억제했고 merimepodib 가 약간 더 빠른 반응을 보였다고 발표. Merimepodib는 RNA 중합효소 저해제로 remdesivir와 동일한 기제. Vertex Pharma에서 C형 간염과 건선 치료를 위해 개발했던 물질.
Cytokine Storm/ARDS 치료제
※ Cytokine Storm: 병원균 등에 의해 촉발된 과도한 면역작용에 의해 면역 시스템이 환자 자신의 기관을 공격하는 증상
※ ARDS (Acute Respiratory Distress Syndrome): 급성호흡곤란증후군. COVID-19의 주 사망원인이며 Cytokine Storm과 연관되어 있을 것으로 추정.
Alexion Pharmaceuticals (ALXN): 중증 폐렴 혹은 ARDS를 지닌 입원 Covid-19 환자 270명을 대상으로 한 Ultomiris의 임상 3상 계획을 발표.
Karyopharm Therapeutics (KPTI): 중증 Covid-19 환자에 대한 selinexor의 임상시험에서 첫 환자 투여가 이루어졌다고 발표. 230명 대상 임상시험을 진행중이고 primary endpoint는 Ordinal Scale에 따른 임상적 개선. Selinexor는 단백질의 핵에서 세포질로의 이동을 담당하는 XPO1 단백질의 저해제로 XPO1 은 SARS-CoV-2의 증식에 중요한 역할을 한다고 함. Selinexor는 2019년 7월 Xpovio라는 제품명으로 항암제로 FDA 승인을 받았음.
aTyr Pharma (LIFE): Covid-19로 인한 ARDS 환자에 대한 ATYR1923의 임상2상에 대해 FDA의 허가를 받음. ATYR1923은 T세포 반응을 감소시키도록 디자인된 융합단백질.
AstraZeneca (AZN): 장기부전 위험이 있는 중증 Covid-19 환자 900명을 대상으로 당뇨병약 Farxiga의 임상3상을 진행한다고 발표.
Baxter International (BAX): FDA가 Oxiris purification를 EUA 승인. Oxiris purification은 Covid-19 환자의 혈액에서 염증성 싸이토카인을 제거하는데 사용될 예정.
Mesoblast Limited (MESO): 자사의 동종이계 중간엽 줄기세포 (allogeneic mesenchymal stem cell, MSC) 치료제 후보물질 remestemcel-L를 투여한 인공호흡기 의존적 Covid-19 환자에서 투여후 5일 이내에 83% (10/12)의 생존율을 보였다고 발표. 10명중 9명은 평균 10일후 인공호흡기를 제거했고 7명은 퇴원. 반면 뉴욕시 병원에서 표준치료를 받은 동일 환자군의 9%만 인공호흡기를 제거할 수 있었고 생존율은 12% (38/320)에 불과하다고 함.
백신
※ 애쥬반트: 항원만으로는 부족할 수 있는 면역반응을 도와 항체 생성이 잘 일어나도록 면역을 증강시킬 목적으로 백신에 첨가되는 물질.
※ Convalescent Plasma: 회복된 환자의 혈액에서 분리한 혈장 혹은 그 혈장 내 항체를 이용한 치료
Vaxart (VXRT): 동물실험에서 자사의 백신 후보물질들 중 여럿에서 접종 2주 후 항체가 형성됐다고 발표.
BioNTech (BNTX), Pfizer (PFE): Moderna 만큼 많이 알려지지는 않았지만 상장전부터 Moderna 의 라이벌로 언급되던 독일 기업. 규모면에서도 시가총액이 임상단계 바이오텍 치고는 상당히 큰 약 $11B (Moderna 약 $17B). Moderna 처럼 mRNA 플랫폼이 주 모달리티지만 mRNA 이외에도 항체 등 다양한 모달리티를 개발중. Pfizer와 공동으로 진행중인 Covid-19 백신 프로그램 임상 1/2상이 독일의 Paul-Ehrlich Institut에서 시작한다고 발표. 용량 증가 (dose escalation) 임상시험에 약 200명 정도를 모집할 계획이고 반복 접종의 효과에 대해서도 점검할 계획. 미국에서의 임상시험도 조만간 론칭 계획. Spike 단백질 하나를 항원으로 개발한 한가지 후보물질 (mRNA-1273) 만으로 임상시험을 시작한 Moderna와 달리 SARS-CoV-2의 두가지 항원을 대상으로 개발된, 3가지 유형의 mRNA 플랫폼의 네가지 후보물질을 테스트할 예정.

Translate Bio (TBIO), Sanofi (SNY): Sanofi와 mRNA 백신을 공동 개발 중. Sanofi의 실적 발표 컨콜에서 4분기에 임상시험을 시작하고 결과에 따라 2021년 하반기 승인을 받을 수 있다고 언급.
Dynavax (DVAX): 프랑스의 Valneva의 백신 개발에 자사의 CpG 1018 애쥬반트를 공급하기로 계약. CEPI (University of Queensland), 중국의 Clover와 Sinovac에 이은 네번째 CpG 1018 애쥬반트 공급 계약. CpG 1018는 TLR9 agonist로 면역반응을 높여줌. Dynavax의 B형 간염 백신 HEPLISAV-B에 사용중.
Johnson & Johnson (JNJ), Emergent BioSolutions (EBS): 임상시험 진행과 더불어 효과를 보일시 EUA로 바로 사용할 수 있도록 빌리온 도즈의 생산까지 병용하기로 한 J&J가 Emergent BioSolutions와 $135M의 백신 생산 계약 체결. Emergent BioSolutions는 이미 Novavax, Vaxart에서 개발중인 백신의 생산을 담당하기로 계약을 체결했고 BARDA의 지원을 받아 혈장 치료법 (Convalescent Plasma) COVID-HIG을 개발 중. Emergent BioSolutions는 미국 바이오디펜스 분야의 대표적인 기업.
Inovio Pharmaceuticals (INO): CNBC와의 인터뷰에서 CEO Joseph Kim은 4월말까지 40명의 백신 임상시험 참가자 모집을 종료할 계획이라고 밝힘. 현재 한국 정부의 지원을 받아 한국에서 임상시험 중.
코로나-19 백신 개발을 통해서 본 백신 플랫폼
백신이란? 항원, 즉 병원체를 약하게 만들어 인체에 주입하여 항체를 형성하게 하여 그 질병에 저항하는 후천 면역이 생기도록 하는 의약품 (출처:위키피디아) WHO의 4/4자 자료를 보면 현재 SARS-CoV-2에 대한 백..
woojkim71.tistory.com
[기타]
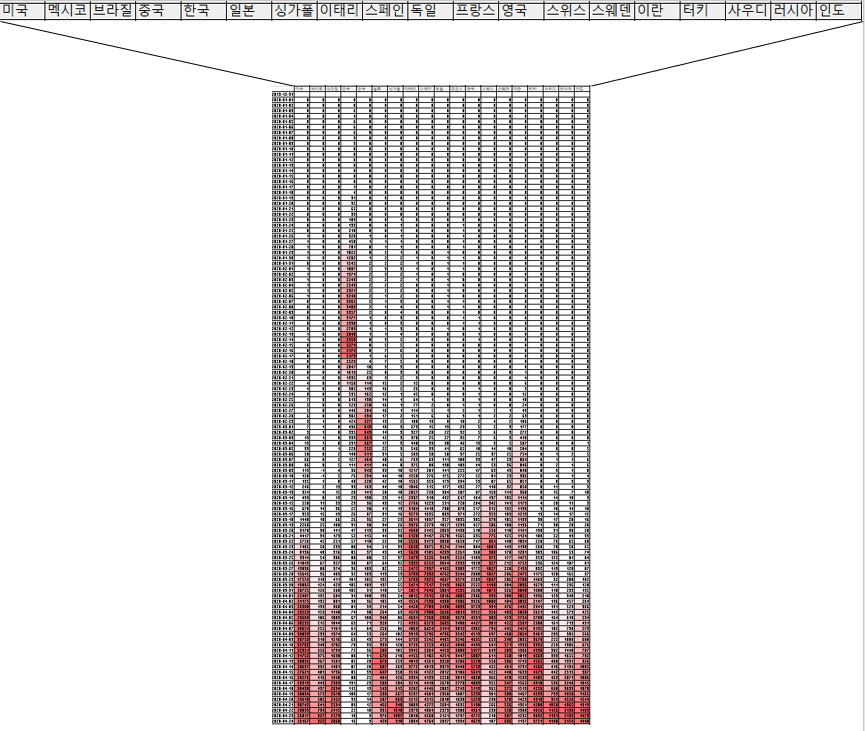
Our World in Data의 자료를 바탕으로 주요국 일일 신규확진자수 heat map을 한번 만들어봤습니다. 유럽 국가들 중에는 독일과 스위스가 reopening 드래프트 마련에 들어갔는데 스위스는 확실히 감소세가 보이고 독일은 속도가 느리게 감소하고 있습니다. 미국은 글쎄요입니다. 너무 이른듯 보이네요. 최근에는 브라질, 멕시코, 영국, 터키, 사우디, 러시아, 인도의 환자수 증가세가 가파릅니다.
| Symbol | Name | Weekly Gain | 시가총액 |
| S&P500 (SPY) | SPDR S&P 500 ETF Trust | -1.28% | |
| Nasdaq100 (QQQ) | PowerShares QQQ Trust, Series 1 | -0.67% | |
| 바이오텍 (XBI) | SPDR S&P Biotech | 5.96% | |
| MESO | Mesoblast limited | 125.55% | 8.3B |
| INO | Inovio Pharmaceuticals Inc | 76.63% | 2.1B |
| VXRT | Vaxart Inc | 51.76% | 217.6M |
| BSGM | BioSig Technologies Inc | 51.04% | 225.9M |
| CDXC | Chromadex Corp | 30.48% | 291.8M |
| TBIO | Translate Bio Inc | 26.01% | 771.9M |
| LIFE | aTyr Pharma Inc | 21.89% | 33.9M |
| NBY | NovaBay Pharmaceuticals, Inc. | 18.42% | 25.2M |
| BNTX | BioNTech SE - ADR | 17.01% | 10.8B |
| DGX | Quest Diagnostics Inc | 11.76% | 14.3B |
| LH | Laboratory Corp. of America Holdings | 10.23% | 15.9B |
| EBS | Emergent Biosolutions Inc | 9.14% | 3.8B |
| KPTI | Karyopharm Therapeutics Inc | 7.42% | 1.8B |
| CERS | Cerus Corporation | 7.40% | 917.0M |
| PKI | PerkinElmer, Inc. | 4.69% | 9.7B |
| ENZ | Enzo Biochem, Inc. | 4.60% | 118.9M |
| ALXN | Alexion Pharmaceuticals, Inc. | 4.48% | 24.0B |
| SNY | Sanofi SA | 4.40% | 62.5B |
| AZN | AstraZeneca plc | 2.30% | 67.2B |
| JNJ | Johnson & Johnson | 1.87% | 408.3B |
| AYTU | Aytu Bioscience Inc | 1.45% | 81.5M |
| PFE | Pfizer Inc. | 1.27% | 207.4B |
| ANIX | Anixa Biosciences Inc | 1.01% | 42.2M |
| DVAX | Dynavax Technologies Corporation | 0.00% | 297.8M |
| BAX | Baxter International Inc | -0.03% | 47.1B |
| NVS | Novartis AG | -0.27% | 225.1B |
| ABT | Abbott Laboratories | -2.03% | 165.9B |
| GILD | Gilead Sciences, Inc. | -5.18% | 100.3B |
'Covid-19' 카테고리의 다른 글
| Weekly COVID-19 Review 20200501 (0) | 2020.05.04 |
|---|---|
| Remdesivir (한국명 렘데시비르) 정리 (2) | 2020.05.03 |
| Weekly COVID-19 Review 20200417 (4) | 2020.04.18 |
| Weekly COVID-19 Review 20200410 (2) | 2020.04.11 |
| 코로나-19 백신 개발을 통해서 본 백신 플랫폼 (4) | 2020.04.07 |
