2021년 주목해야할 바이오 키워드: 유전자 편집
작성일 2021.1.3
#CRISPR Therapeutics (CRSP) #Editas Medicine (EDIT) #Intellia Therapeutics (NTLA) #Beam Therapeutics (BEAM) #Sangamo Therapeutics (SGMO) #Cellectis SA (CLLS) #Precision BioSciences (DTIL)
-------------------------------------------------<Key Point>--------------------------------------------
❏ 유전자 편집은 과거 공상 과학 영화에서나 다뤄지던 상상속의 기술이었다. 유전자 편집을 이용한 치료제를 개발중인 기업들이 2010년대 중반 이후 다수 등장했지만 임상시험에서 유용성을 입증한 기업은 없었다.
❏ 2020년 12월 CRISPR Therapeutics는 크리스퍼 유전자 가위를 이용한 최초의 유의미한 임상시험 결과를 발표했다.
❏ 크리스퍼 유전자 가위를 비롯한 대표적인 유전자 편집 기업들은 2020년을 기점으로 모두 임상 단계로 진입했다. 즉 2021년 이후로 유전자 편집을 이용한 치료제들의 임상 시험 결과들이 하나 둘 나오기 시작한다. 아직은 여전히 유전자 편집의 개념 증명 단계지만 실현 가능성은 현실에 가까워지고 있다.
-------------------------------------------------<본 내용>-------------------------------------------------
2021년을 새해를 맞아 제약-바이오 산업 내에서 주목할 만한 분야들 중 유전자 편집에 대해 소개하고자 한다.
2020년 하반기 유전자 편집, 특히 크리스퍼 유전자 가위는 제약-바이오 산업 내에서 뜨거운 주제 가운데 하나였다. 2020년 노벨 화학상은 크리스퍼 유전자 가위의 작용 기제를 규명하고 응용 가능성을 보여준 두명의 여성 과학자 제니퍼 다우드나 (UC 버클리, 미국)와 엠마누엘 샤펜티에 (막스 플랑크 연구소, 프랑스) 교수가 공동 수상했다.
또한 엠마누엘 샤펜티에 교수가 공동 설립자로 있는 CRISPR Therapeutics가 크리스퍼 유전자 가위를 이용한 최초의 유의미한 임상시험 결과를 발표했다.
그리고 올해 가장 좋은 수익율을 올린 액티브 펀드 ARK 인베스트먼트 매니지먼트의 캐시 우드 최고 경영자가 블룸버그와의 인터뷰에서 테슬라 이후로 크리스퍼 유전자 가위를 위시한 유전체 분야를 주목하고 있음을 밝혔다. ARK 인베스트먼트는 올해 기록적인 주가 상승을 이룬 테슬라를 오랜 기간 펀드의 최대 비중 종목으로 보유하고 있던 것으로 유명하다.
이상의 호재들이 겹치면서 크리스퍼 유전자 가위 치료제를 개발중인 기업들은 물론 여타 유전자 편집을 이용한 치료제를 개발중인 기업들의 주가가 12월 이후 랠리를 보였다.
필자는 그동안 실험실에서의 가능성으로만 존재하던 유전자 편집 분야의 실제 임상 시험 결과들이 올해부터 본격적으로 나오기 시작한다는 점에 주목한다. 2020년 말 CRISPR Therapeutics의 임상 결과는 그 시작에 불과하다.
이제 개화기에 막 들어서기 시작한 유전자 편집 분야. 이 분야에 어떤 기업들이 있고 어떤 기술로 치료제를 개발 중인지에 대해 살펴본다.
기업 소개에 앞서 이 분야에 익숙하지 않은 독자들을 위해 유전자 편집을 이해하기 위해 알아야할 점들을 짚고 넘어가자.
유전자 편집과 유전자 치료
치료용으로 개발중인 유전자 편집 (gene editing)과 유전자 치료 (gene therapy)는 어떻게 다른 것일까? 광범위하게 보자면 유전자 편집은 유전자 치료의 일종이라고 할 수 있다. 하지만 현재 개발중인 치료제들로만 한정해서 비교해 보자면 유전자 치료는 망가진 유전자를 대신해 외부에서 세포내로 추가적인 정상 유전자를 공급해주는 치료법을 의미한다. 반면 유전자 편집은 세포 내 염색체 상에 원래 존재하던 유전자를 편집하는 기술을 뜻한다 (주: 유전자 편집은 치료용 이외에도 진단, 동식물 품종 개조, 연구용 등 다른 응용 목적으로도 광범위하게 개발되고 있는데 치료용 이외의 사용은 논외로 한다). 편집해야할 원래 염색체상의 유전자를 대신해 추가적인 유전자를 외부에서 공급해주는 대신 염색체상의 원래 유전자를 편집할 수 있는 도구들을 세포에 넣어주는 것이다.
비유하자면 노트북 컴퓨터의 모니터가 망가진 경우 유전자 치료는 망가진 모니터를 그대로 둔 채 외부 모니터를 하나 달아주는 것이고, 유전자 편집은 망가진 노트북 모니터를 고쳐서 사용하는 것을 뜻한다. 아무래도 전자의 경우 여러가지로 불편함이 있을 수 있다.
유전자 치료의 경우 치료 후에도 망가진 유전자는 그대로 염색체 상에 존재하게 된다. 추가된 유전자는 염색체 바깥에 존재하거나 (episomal) 원래 그 유전자가 있어야할 염색체상의 부위가 아닌 다른 부위에 삽입된다 (chromosomal integration). 염색체 바깥에 추가된 유전자가 존재하는 경우에는 세포 분열을 하면서 점차로 넣어준 유전자가 소실된다. 염색체에 삽입시킨 경우에도 세포 본래의 생리적인 유전자 발현 조절로부터 벗어날 뿐만 아니라 원래 그 유전자가 있어야할 위치가 아닌 다른 부위에 무작위로 삽입되기 때문에 다른 질병을 유발할 가능성도 있고, 세포 입장에서는 외부에서 침입한 불순물로 인식해 이를 제거하려는 노력을 하게 된다.
반면 유전자 편집은 기본적으로 염색체상에 존재하는 원래의 유전자에 대한 편집이기 때문에 편집 후 세포의 생리적인 유전자 발현 조절을 받게 된다. 유전자 편집의 경우 편집 도구들이 외부 불순물이기 때문에 세포가 이들을 제거하려고 하고 이때문에 편집 효율에는 문제가 발생할 수 있다. 하지만 한번 편집된 염색체상 유전자가 세포에 의해 제거될 수는 없다. 최근 유전자 치료의 장기 추적 임상시험에서 유전자 발현이 치료 초기만큼 유지되지 않는 현상이 문제로 부각되고 있다. 유전자 편집을 이용한다면 이 부분이 해소될 수 있을 것으로 기대하고 있다.
유전자 편집 기술의 종류
유전자 편집은 기본적으로 ① 염색체상 유전자의 특정 염기서열을 인식하고 ② 인식한 특정 염기서열 근처의 원하는 부위를 절단한 후 ③ 세포의 (상동 혹은 비상동) 재조합 기제를 이용해 절단된 염색체를 복구하는 세 단계로 이루어진다. 유전자 편집 플랫폼은 이 세 단계를 수행하는 핵산 분해 효소 (nuclease) 및 작용 기제에 따라 크게 ① 크리스퍼 (CRISPR) ② 탈렌 (TALEN) ③ 징크 핑거 핵산 분해 효소 (Zinc Finger Nuclease, 이하 ZFN) ④메가 핵산 분해 효소 (Meganuclease)의 4가지로 구분된다.
국내에서는 가장 잘 알려진 세개의 유전자 편집 기술을 흔히 1세대 (ZFN), 2세대 (탈렌), 3세대 (크리스퍼)로 표현한다. 이는 마치 세 기술이 이전 세대 기술을 계승 발전한 것 같은 오해를 불러 일으킨다. 그러나 각각의 기술은 독자적으로 개발했고 시차가 다르게 등장했을 뿐이므로 본 주식투자전략에서는 이와 같은 표현은 지양한다.
유전자 편집 기술은 위 네 기술을 바탕으로한 여러 종류의 변이들이 존재하는데 비전공 일반인 투자자 입장에서 각각의 기술적 측면에 대해 상세히 이해하는 것은 쉽지도 않고 알 필요도 없을 것 같다. 미국 상장 기업들이 개발중인 대표적인 플랫폼들의 장단점을 간단하게만 살펴보면 아래 표와 같이 요약할 수 있다.
유전자 편집 플랫폼 비교
| 크리스퍼 | 탈렌 | ZFN | 메가 핵산 분해 효소 | |
| DNA 특정 염기서열 인식 방법 | DNA-RNA 상동 결합 | 단백질:DNA 결합 | 단백질:DNA 결합 | 단백질:DNA 결합 |
| 특정 염기서열 인식을 위한 조작의 용이성 | 매우 용이 | 어려움 | 어려움 | 매우 어려움 |
| 정확도 | 높음 (오프 타겟* 보고) | 매우 높음 | 매우 높음 | 가장 높음 (오프 타겟 없음) |
| 생체내 세포 전달 용이성 | 어려움 (전달체 사이즈 큼) | 매우 어려움 (전달체 사이즈 크고 재조합 가능성 높음) | 용이 (전달체 사이즈 작음) | 매우 용이(전달체 사이즈 가장 작음) |
| 두개 이상 부위 동시 조작 용이성 | 쉬움 | 어려움 | 어려움 | 어려움 |
| 면역원성 | 높음 (박테리아 유래) | 높음 (식물 유래) | 낮음 (사람 유래) | 높음 (박테리아 유래) |
| 제작 가격 | 매우 저렴 | 고가 | 고가 | 고가 |
| 제작 기간 | 매우 짧음 | 오래 걸림 | 오래 걸림 | 오래 걸림 |
| 관련 기업 | CRSP EDIT NTLA BEAM | CLLS | SGMO | DTIL CLLS |
출처: 필자 자체 제작. 2021.1.3. (*오프 타겟: 원하는 부위가 아닌 다른 부위의 유전자가 조작되는 현상)
가장 크게 주목받고 있고 2020년 노벨 화학상 수상의 주인공이기도 한 크리스퍼의 경우 특정 DNA 염기서열 인식 방법에서 여타 유전자 편집 플랫폼들과 가장 큰 차별화를 보인다. 크리스퍼를 제외한 유전자 편집 플랫폼들은 짧은 특정 DNA 염기서열을 인식하는 다수의 단백질들을 모듈화해서 원하는 긴 DNA 염기서열 인식부위에 결합하는 모듈들의 신조합으로 구성된 새로운 단백질을 만들어야한다. 이 과정은 만드는데에도 시간이 많이 소요될 뿐 아니라 만들어진 모듈의 새로운 조합이 원하는 타겟 DNA를 정확하게 인식하는지에 대한 검증 및 최적화 과정을 거쳐야하므로 많은 시간과 비용이 소요된다.
반면 크리스퍼의 경우 자연적으로 존재하는 DNA-RNA의 상동 결합을 이용한다. 원하는 타겟 DNA 염기서열에 결합하는 RNA 염기서열을 DNA 형태로 합성해주면 되기 때문에 시간과 비용면에서 여타 플랫폼들에 비해 월등하게 뛰어나다. 하지만 정확도 및 생체내 세포 전달, 면역원성 등에서 여타 플랫폼들과 비교해 단점이 있기 때문에 크리스퍼 이전에 개발되던 플랫폼들 역시 크리스퍼 등장 이후에도 치료제 개발을 위해 다양하게 사용되고 있다.
유전자 편집을 이용한 치료제의 종류
현재 유전자 편집을 이용한 치료는 크게 in vivo와 ex vivo 치료제로 나눌 수 있다. In vivo는 라틴어로 ‘체내에서 진행되는’ 이라는 의미를 지닌다. 유전자 편집에 필요한 도구들을 바이러스, 지질 나노입자 (lipid nanoparticle, LNP)등을 이용해 체내의 타겟 세포로 전달해 몸 안에서 유전자 편집 및 치료가 일어나도록 하는 방식이다. 유전자 편집이 궁극적으로 나아가야할 방향이지만 여러가지 극복해야할 문제점들이 있고 난이도가 높은 까닭에 대부분의 기업들이 in vivo 치료제 개발은 사이드로 하고 있다.
반면 ex vivo는 유전자 편집이 필요한 세포를 몸 밖으로 꺼내 유전자 편집을 수행한 후 몸 안으로 다시 되돌려 보내는 방식이다. 필요한 세포들만을 모아 시험관 안에서 유전자 편집 도구들을 전달할 수 있어서 in vivo 보다 훨씬 효과적이고 in vivo에서 하기 어려운 방법들도 사용할 수 있다. 현재 대부분의 유전자 편집 기업들이 ex vivo 방식의 치료제를 개발중이다. 그러나 이 방식은 유전자 편집할 세포를 몸 밖으로 꺼내기 용이한 혈액 세포로 용도가 한정되어 있다는 단점이 있다.
현재 ex vivo 방식의 유전자 편집 치료제는 크게 두가지 방식으로 개발되고 있다. 첫번째는 단일 유전자의 돌연변이로 인해 발생한 유전성 혈액 질환을 대상으로 질병의 원인이 되는 유전자를 직접 편집하거나 발현을 조절하는 유전자를 편집하는 방식이다. 혈우병, 지중해 빈혈, 겸상 적혈구증 등이 이에 해당한다. 두번째는 면역 세포를 유전자 편집으로 조작한 후 치료에 사용하는 방식으로 주로 암 치료를 위한 면역 세포 치료제 (CAR-T, TCR-T, NK 등)의 개발에 사용하고 있다. 전자의 경우 유전자 편집 자체가 치료인 반면 후자의 경우 치료용 세포 제작을 위해 유전자 편집을 도구로 이용한다는 첨에서 차이가 있다.
유전자 편집 기업들이 개발중인 면역 세포 치료제는 대표적으로 CAR-T (Chimeric Antigen Receptor T 세포)가 있다. CAR-T는 유전자 조작을 통해 환자의 T세포가 암세포의 표지 단백질을 인식하도록 하여 암세포를 공격하는 세포 치료법으로 다른 치료법들이 실패한 환자들을 대상으로 100%에 가까운 완치율을 보이며 기적의 치료제로 각광받고 있다. 2017년 노바티스의 Kymriah가 FDA의 첫 승인을 받은 후 현재까지 Gilead Sciences의 Yescarta와 Tecartus 등 총 3종의 CAR-T가 혈액암 치료제로 승인받았다.
현재 승인받고 사용중인 CAR-T는 환자의 피에서 T세포를 분리해 시험관에서 배양하고 유전자 조작을 한 후 다시 배양을 해야하는 환자 맞춤형 치료제다. 그러나 긴 공정 때문에 치료제 제작에 최소 1-2개월이 소요되고 환자 개개인의 맞춤형이기 때문에 제작 가격이 높다는 단점이 있다. 부작용이 심해 주로 말기 암 환자들에게 사용되는 치료제이기 때문에 이 1-2개월은 환자에게 치명적일 수 있다.
유전자 편집 기업들이 개발중인 CAR-T를 비롯한 면역 세포 치료제들은 이와 같은 단점을 극복하기 위해 건강한 성인의 T세포를 유전자 조작을 통해 CAR-T로 미리 만들어 놓고 환자가 필요할 때 바로 투여할 수 있도록 한 치료제다. 유전자 편집을 통해 타인의 세포가 환자몸에 이식될 때 일어나는 이식 거부 반응에 관련된 유전자들을 불활성화시킬 수 있기 때문이다. 이를 ‘기성품’ (off-the-shelf) 혹은 ‘동종 이계’ (allogeneic) CAR-T라고 부르며 향후 환자 맞춤형 CAR-T를 대체할 것으로 전망되고 있다.
Ex vivo와 In vivo의 차이
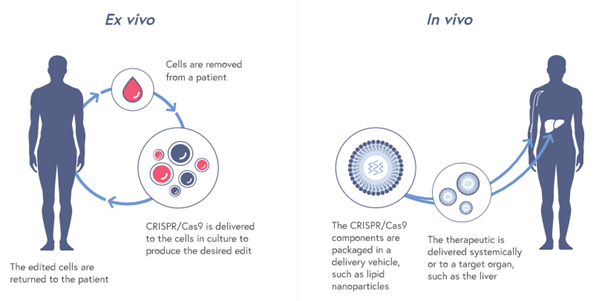
출처: CRISPR Therapeutics 발표 자료. 2021.1.3., http://www.crisprtx.com/gene-editing/therapeutic-approach
주요 기업들
이상 유전자 편집에 대해 알아야할 사항들에 대해 간략히 살펴봤다. 이제부터 유전자 편집의 대표적인 기업들 7군데에 대해 간단하게 살펴보고자 한다.
CRISPR Therapeutics (CRSP)
2013년 설립된 스위스에 본사를 둔 바이오테크 기업으로 사명에서 보듯 크리스퍼 유전자 가위를 이용한 치료제를 개발하는 기업이다. 미국 샌프란시스코와 보스톤에 지사를 두고 있다. 2020년 크리스퍼 유전자 가위로 노벨상을 공동 수상한 엠마누엘 샤펜티에 교수가 공동 설립자다. 2016년 Editas Medicine, Intellia Therapeutics 보다 몇 달 늦게 상장했지만 설립 초반 in vivo 치료에 집중해온 두 기업과 달리 처음부터 ex vivo에 집중하면서 세 크리스퍼 기업들 가운데 가장 먼저 임상시험을 시작했다. 유전자 편집 기업들 가운데 가장 시가 총액이 크고 현금 보유량 또한 가장 풍부하다.
Vertex Pharmaceuticals와 공동으로 헤모글로빈 유전자의 변이로 발생하는 지중해 빈혈 (β-thalassemia)와 겸상 적혈구증 (sickle cell disease) 치료제 CTX001을 개발중이다. 2019년 말 지중해 빈혈과 겸상 적혈구증 환자에 각 한 명씩에 대한 최초의 크리스퍼를 이용한 임상시험 결과를 발표하면서 가능성을 보였고, 2020년 6월 유럽 혈액학회(EHA)에서 지중해 빈혈과 겸상 적혈구증 각각 2명과 1명의 결과를 발표한 뒤 올해 12월 미국 혈액 학회(ASH)에서 지중해 빈혈과 겸상 적혈구증 각각 13명과 6명의 결과를 발표했다. 올해 12월 결과는 크리스퍼를 이용한 치료로는 최초의 유의미한 임상시험 결과라고 볼 수 있다. 초기 치료 효과는 뛰어났는데 동일 적응증에 대한 유전자 치료제 후보물질들이 치료후 기간이 경과할수록 치료 효과가 떨어지는 현상을 보이고 있어 CTX001 역시 이와 같은 문제가 발생하지 않는지 장기간의 추적 조사가 필요하다.
CTX001 외에 기성품 CAR-T인 CTX110 (CD19 타겟)의 임상 1상 첫 결과를 2020년 10월에 발표했고 추가 업데이트를 올해 발표할 예정이다. 또한 2020년 임상시험에 들어간 기성품 CAR-T CTX120 (BCMA 타겟), CTX130 (CD70 타겟), CTX130 (CD70 타겟)의 첫 결과가 올해 발표될 예정으로 다수의 임상 시험 결과 발표들이 대기 중이다. ViaCyte와 공동으로 1형 당뇨병에 대한 기성품 줄기세포 치료의 임상 1상은 올해 시작할 예정이다.
CRISPR Therapeutics의 파이프라인

출처: CRISPR Therapeutics 발표 자료. 2021.1.3. http://www.crisprtx.com/assets/uploads/CRISPR-Tx-Corporate-Overview-November-2020.pdf
Editas Medicine (EDIT)
2013년 설립된 크리스퍼 유전자 가위를 이용한 치료제를 개발하는 바이오테크 기업으로 보스톤에 본사를 두고 있다. 포유동물 세포에서 크리스퍼 유전자 가위의 적용을 처음 발표한 팽 장 교수 (Broad Institute of Havard/MIT)를 포함한 4명의 하버드/MIT 교수들이 설립했다. 2016년 2월에 크리스퍼 개발 기업들 가운데 가장 먼저 상장했다. 그러나 in vivo 치료에 집중하면서 CRISPR Therapeutics에 비해 개발이 다소 뒤쳐졌다.
Allergan과 공동으로 2020년 3월 in vivo 크리스퍼 유전자 치료제로는 최초로 EDIT-101의 임상 1/2상을 시작했다. EDIT-101은 레베르 선천성 흑암시 10 (Leber congenital amaurosis 10, LCA10)이라는 출생시 혹은 출생 직후에 선천실명을 일으킬 수 있는 유전성 희귀 안과질환에 대한 유전자 편집 후보물질이다. 안과 질환은 in vivo이면서 국부 투여가 가능하다는 장점이 있다. 그러나 2020년 8월 AbbVie의 Allergan 인수가 완료되면서 AbbVie의 주력 분야가 아닌 안과질환의 EDIT-101 프로그램은 Editas Medicine으로 반납되서 독자 개발중이다. 2020년 11월 저용량군의 투여가 완료됐고 올해 중후반의 유전자/세포 치료 학회나 안과 관련 학회에서 최초의 in vivo 크리스퍼 임상시험 중간 결과 발표가 기대된다.
2020년 12월 겸상 적혈구증에 대한 EDIT-301의 임상 1/2상의 시작을 위한 서류(IND)를 FDA에 제출했다. 올해 초 첫 ex vivo 임상 시험을 시작할 수 있을 것으로 보여 12월에 열릴 미국 혈액학회(AHS)에서 첫 결과를 볼 수 있을 것으로 기대된다. 또다른 ex vivo 프로그램인 고형암에 대한 EDIT-201(기성품 NK세포)의 임상 1/2상은 2020년 말까지 IND를 제출할 예정이었지만 연말까지 업데이트가 없었다. 올해 초 IND 제출 발표와 임상 시험 시작이 있을 것으로 기대되는데 혈액암보다 시장이 큰 고형암을 대상으로 하는 만큼 시장의 기대감이 크다고 볼 수 있다.
Editas Medicine은 in vivo 치료제에는 기존의 크리스퍼/Cas9 시스템을, ex vivo 치료제에는 크리스퍼/Cas12a 시스템을 사용하고 있다. Editas Medicine과 CRISPR Therapeutics가 각각 크리스퍼/Cas9의 특허를 라이선싱한 Broad Institute와 CVC 그룹간에는 지리한 특허 분쟁이 미국과 유럽 등지에서 벌어지고 있는데 현재까지의 판결들은 어느 한쪽의 손을 들어줬다고 볼 수 없는 애매한 판정들이다. 그러나 소송 결과에 따라 어느 한쪽이 치명타를 입을 수 있으므로 크리스퍼/Cas12a을 대안으로 지니고 있다는 점은 강점이다.
Editas Medicine의 파이프라인

출처: Editas Medicine 발표 자료. 2021.1.3. https://ir.editasmedicine.com/static-files/03350a40-33d7-413c-b2d6-c46f94ab273f
Intellia Therapeutics (NTLA)
2014년 설립된 크리스퍼 유전자 가위를 이용한 치료제를 개발하는 바이오테크 기업으로 보스톤에 본사를 두고 있다. 2020년 노벨 화학상을 공동 수상한 제니퍼 다우드나 교수가 공동 설립자다. Editas Medicine, CRISPR Therapeutics와 같은 해인 2016년에 상장했다. Editas Medicine 처럼 in vivo에 먼저 집중했는데 in vivo이면서도 국부 투여가 가능한 안과 질환을 선택한 Editas Medicine과 달리 전신 투여를 해야하는 질환을 선택하면서 세 크리스퍼 개발 기업들 가운데 가장 임상시험이 늦어졌다.
In vivo 프로그램은 리제너론과 공동으로 유전성 트랜스타이레틴 아밀로이드증 (hereditary transthyretin amyloidosis, hATTR)에 대해 개발중인 NTLA-2001이 전신 크리스퍼 치료제로는 최초로 2020년 11월에 환자 투여가 시작됐다. 첫 중간 결과는 2020년 하반기 경에 신경질환 관련 학회에서 볼 수 있을 것으로 예상한다. 또한 유전성 혈관부종 (HAE)에 대한 NTLA-2002의 임상 1상을 올해 시작한다고 발표했다.
Ex vivo 프로그램은 노바티스와 공동으로 겸상 적혈구증에 대해 개발중인 OTQ923/HIX763의 임상 1/2상이 2020년 3월에 시작됐다. 첫 결과는 5월의 유전자/세포 치료 학회(ASGCT)나 6월 유럽 혈액학회(EHA)에서 나올 것으로 예상한다. 또한 급성 골수성 백혈병에 대한 기성품 TCR-T세포 치료제 NTLA-5001 (WT1 타게팅)의 임상 1상의 2021년 시작도 예고되어 있다.
Intellia Therapeutics 역시 CRISPR Therapeutics와 마찬가지로 CVC Group 및 역시 제니퍼 다우드나 교수가 설립한 Caribou Biosciences, 그리고 CRISPR Therapeutics로부터 크리스퍼/Cas9을 라이선싱했다. 따라서 크리스퍼/Cas9에 대한 특허 분쟁에서 자유롭지 못하다.
Intellia Therapeutics의 파이프라인
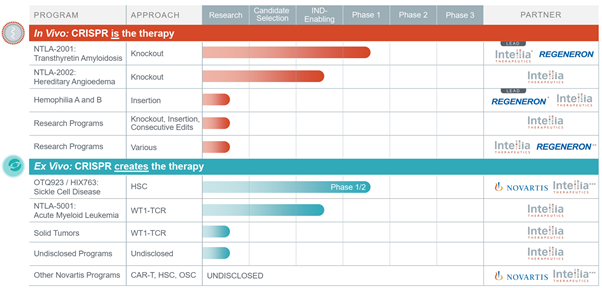
출처: Intellia Therapeutics 발표 자료. 2021.1.3. https://ir.intelliatx.com/static-files/a57908a6-aaca-404d-9072-32471cd3d41e
Beam Therapeutics (BEAM)
Beam Therapeutics는 Editas Medicine의 공동 설립자 4명 중 3명 (데이비드 류, 펭 장, 키스 정 – 한국계)의 하버드 교수들이 2018년 설립했고 2020년 2월에 신규 상장한 기업이다. 위 세 기업들과 마찬가지로 역시 보스톤에 소재해 있다. 가장 최근에 상장했고 아직 임상시험을 시작한 프로그램이 없음에도 불구하고 유전자 편집 기업들 가운데 CRISPR Therapeutics 다음으로 시가 총액이 높을 정도로 기대감이 크다. 그 이유는 Beam Therapeutics의 유전자 편집이 여타 크리스퍼나 TALEN, ZFP 등의 유전자 편집과는 차별화된 진정한 편집이기 때문이다.
다른 유전자 편집 기술들은 DNA의 특정 부위를 절단하는 기제에서 출발한다. DNA 특정 부위의 절단 후 비상동 재조합을 이용해 유전자를 불활성화 시키거나 상동 재조합을 이용해 외부에서 공급된 유전자와 바꿔치기하는 방식이 주를 이룬다. 후자의 경우 아직은 효율이 높지 못해 in vivo에서의 사용은 제한적이다.
Beam Therapeutics의 염기 편집 (base editor) 플랫폼은 크리스퍼의 핵산 분해 효소 활성 부위를 아민 제거 효소 (deaminase)로 대체한 융합 효소를 이용해 DNA를 절단하지 않고도 특정 부위의 염기를 다른 염기로 치환할 수 있다.
기존 세개의 크리스퍼 개발 기업들이 모두 개발중인 겸상 적혈구증을 예로 그 방법의 차이를 설명해보자. DNA를 절단하는 크리스퍼 유전자 가위 기술로는 헤모글로빈 유전자에 발생한 돌연변이를 정상 유전자 서열로 바꿔 놓기 위해서는 앞서 언급한 상동 재조합을 이용해야한다. 그러나 이 방법에는 어려움이 있어서 대신 성인이 되면 유전자 발현이 비활성화되는 태아 헤모글로빈(HbF)를 재활성화시키는 방법을 이용한다. 이를 위해 성인의 HbF의 발현을 억제하는 BCL11A라는 유전자를 불활성화시키는 간접적인 치료 방식이다. 반면 Beam Therapeutics의 염기 편집은 헤모글로빈 유전자에 발생한 돌연변이를 염기 치환을 통해 상동 재조합 기제의 이용 없이 직접 정상으로 돌려놓을 수 있다.
Beam Therapeutics의 리드 프로그램은 위에 언급한 겸상 적혈구증으로 2021년 임상시험 시작을 예고해 놓고 있다. 염기 편집 방식의 유전자 편집 결과가 기존 유전자 편집 치료법들과 동일한 수준으로만 나와도 그 파괴력은 엄청날 것으로 예상된다. 결과는 2022년 이후에나 볼 수 있을 것 같다.
Beam Therapeutics의 파이프라인

출처: Beam Therapeutics 홈페이지. 2021.1.3. https://beamtx.com/our-portfolio/
Cellectis SA (CLLS)
탈렌과 메가 핵산 분해 효소를 기반으로 한 유전자 편집 치료제를 개발중인 프랑스 기업으로 미국 뉴욕과 노스캐롤라이나주 랠리에 지사를 두고 있다. 프랑스 주식 시장에 상장되어 있고 미국 시장에는 ADR로 상장되어 있다. 1999년 상장했고 처음에는 메가 핵산 분해 효소로 시작했으나 2011년 미네소타 대학으로부터 탈렌을 라이선싱해서 현재는 탈렌을 이용한 기성품 CAR-T 치료제 개발에 주력하고 있으며 자회사 Calyxt를 설립해 식물 품종 개량 사업도 하고 있다. 탈렌은 원래 식물 세포에서 유래한 핵산 분해 효소다.
Cellectis의 기성품 CAR-T 포트폴리오는 자사 개발 프로그램 3개와 파트너십 프로그램 3개 총 6개로 구성되어 있다. 모두 임상 단계에 진입해 있으며 특히 Servier, Allogene Therapeutics에게 라이선스 아웃해서 개발중인 UCART19/ALLO-501은 기성품 CAR-T 들 중 가장 앞서 있는 프로그램이다. 2020년 ASCO에서 성공적인 첫 임상시험 결과를 발표하며 주목받고 있다.
Cellectis의 자체 기성품 CAR-T 프로그램의 경우 가장 앞서 있는 UCART22 (CD22 타겟)는 2020년 12월 미국 혈액 학회에서의 첫 결과 발표에서 첫 두 환자 모두 완전관해를 보이며 성공적인 출발을 알렸다. UCARTCS1 (CS1/SLAMF7 타겟)프로그램은 사망 환자 발생으로 내려졌던 임상 중단 명령이 2020년 11월 철회되며 임상시험이 재개됐고, UCART123 (CD123 타겟) 프로그램은 2020년 첫 환자에 대한 투여가 이루어졌다. 이 세프로그램은 5월 미국 임상 종양 학회(ASCO), 6월 유럽 혈액학회(EHA), 9월 유럽 종양 학회(ESMO), 11월 면역 항암 학회(SITC), 12월 미국 혈액학회(ASH) 중에 결과 업데이트가 있을 것으로 보이는데 하반기가 유력하다.
Cellectis의 파이프라인

출처: Cellectis 발표 자료. 2021.1.3. https://www.cellectis.com/uploads/files/20201215_Cellectis-Corporate-Presentation.pdf
Sangamo Therapeutics (SGMO)
Sangamo Therapeutics는 1995년에 설립된 유전자 편집 기업들 중 가장 오래된 기업이다. 캘리포니아 리치몬드에 본사를 두고 있고 ZFN을 기반으로한 유전자 편집뿐만 아니라 유전차 치료 프로그램도 진행중이다. 역사가 오래된 기업 답게 가장 많은 수의 프로그램을 보유하고 있으며 Biogen, Gilead Sciences, Novartis, Pfizer, Sanofi, Takeda 등 여섯 군데의 글로벌 대형 제약-바이오 기업들과 파트너십을 맺고 다양한 파이프라인을 개발 중이다. 유전자 편집이 아닌 유전자 치료지만 임상 3상을 진행중이기도 하다.
크리스퍼를 개발 중인 기업들이 상호간에 복잡하게 특허 관계가 얽혀있고, 유전자 편집 적용 방법, 치료제 전달 방법 등을 대부분 외부에서 라이선싱을 해와서 개발하는 것과 달리 특허 관계도 깔끔하고 유전자 편집 이외의 다른 기술들에 대해서도 자사 개발 기술을 다수 보유하고 있다.
최근 Truist Financial에서 주최한 투자자 미팅에서 오랜기간 인수합병 가능성을 닫아놓고 있던 CEO Sandy Macrae가 인수합병에 대해 문을 열어놓고 있다는 발언을 하면서 JP 모건 헬스케어 컨퍼런스를 앞두고 주목받고 있기도 하다.
Sangamo Therapeutics는 현재 두개의 유전자 치료, 두개의 ex vivo 유전자 편집, 한개의 in vivo 유전자 편집으로 구성된 다섯개의 임상 프로그램을 진행중이다. 리드 프로그램은 Pfizer와 공동으로 A형 혈우병에 대해 진행중인 유전자 치료 프로그램으로 2020년 12월 미국 혈액학회에서 임상 1/2상 1년차 추적 결과를 발표했는데 다른 유전자 치료제들처럼 투여 초기에 비해 효과가 줄어드는 모습을 보였다. 올해 12월 미국 혈액학회에서 2년차 추적 결과가 발표될 것으로 보인다. 또한 2020년 10월에 시작한 임상 3상의 첫 중간 결과 역시 올해에 발표될 것으로 보인다. 그밖에 패브리병에 대한 유전자 치료제 ST-92의 첫 결과가 올해 중 발표될 것으로 보인다.
Ex vivo 유전자 편집 프로그램은 사노피와 공동으로 진행중인 겸상적혈구증에 대한 BIVV003의 첫 결과가 올해 중 발표될 것으로 보이고 역시 사노피와 공동 진행중인 지중해 빈혈에 대한 ST-400의 임상 1/2상의 업데이트 결과 역시 발표될 것으로 보인다. 또한 신장이식 거부반응에 대한 환자 맞춤형 CAR-Treg 치료제 TX200, 길리어드 사이언스와 공동 진행하는 기성품 CAR-T KITE-037 (CD19 타겟)의 임상1상이 올해 시작을 예고하고 있다.
In vivo 유전자 편집 프로그램의 경우 2019년 4월에 발표한 임상 결과가 기대에 미치지 못하며 현재는 새 환자의 투여가 중단됐다. 1세대 ZNF보다 개선된 2세대 ZFN을 이용한 새 임상시험을 준비중이라는 보도 이후 특별한 업데이트는 아직 없다.
Sangamo Therapeutics의 파이프라인
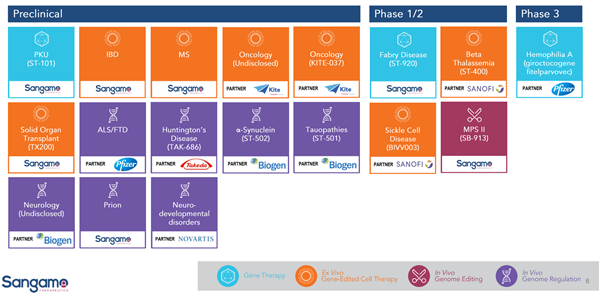
출처: Sangamo Therapeutics 발표 자료. 2021.1.3. https://investor.sangamo.com/static-files/ed989494-b5ef-4b3c-afa6-55aeb993763b
Precision BioSciences (DTIL)
Precision BioSciences는 2006년 설립된 바이오테크 기업으로 노스캐롤라이나 더햄에 소재해있다. 메가 핵산 분해 효소를 이용한 ARCUS 유전자 편집 플랫폼을 보유하고 있으며 Cellectis처럼 ex vivo 기성품 CAR-T 치료제 개발에 주력하고 있다. 최근 Eli Lilly와 전임상 단계 in vivo 유전자 편집 프로그램에 대한 라이선스 계약을 맺었으며 식품 업체들 (Elo Life Systems, Dole)과 파트너십을 맺고 식물 품종 개량 사업도 진행중이다. 메가 핵산 분해 효소로 출발한 Cellectis와 특허 분쟁이 있었으나 합의 후 현재는 상호간에 라이선싱한 관계다.
리드 파이프라인 PBCAR0191 (CD19 타겟)의 임상 1/2상 업데이트 결과가 2020년 12월 미국 혈액학회에서 발표됐다. 1년전 같은 학회에서의 발표보다는 효과가 개선됐으나 유사한 CD19 CAR-T 대비 떨어지는 효능에 주가가 크게 하락했다. 또다른 기성품 CAR-T 프로그램 PBCAR20A (CD20 타겟), PBCAR269A (BCMA 타겟)의 첫번째 용량군 결과가 올해 발표될 것으로 보이며 두번째 용량군의 투여가 시작될 예정이다.
Precision BioSciences의 파이프라인

출처: Precision BioSciences 홈페이지. 2021.1.3. https://precisionbiosciences.com/pipeline/
이상 언급된 기업들 외에도 1세대 CAR-T 개발 기업 bluebird bio (BLUE)가 탈렌과 메가 핵산 분해 효소를 접목한 mRNA 기반의 megaTAL 플랫폼을 개발중이고, Homology Medicines (FIXX)은 핵산 분해 효소 없이 외부 공급된 DNA의 양쪽 끝 부위를 상동 재조합이 잘 일어나도록 조작하는 방식을 통한 유전자 편집 플랫폼으로 전임상 개발중이다. 올해 6월 상장한 Repare Therapeutics (RPTX)는 크리스퍼 유전자 가위를 치료제로 사용하는 대신 후보물질의 스크리닝에 사용하는 플랫폼을 보유하고 있다. 그밖에 제니퍼 다우드나 교수가 설립한 비상장 기업 Caribou Biosciences와 Mammoth Biosciences는 크리스퍼를 이용한 진단 기술을 개발중인데 크리스퍼의 상업화는 치료제보다는 진단 쪽에서 먼저 이루어질 것으로 전망된다.
유전자 편집 기업들의 비교
| 기업명 | CRISPR Therapeutics AG | Editas Medicine | Intellia Therapeutics | Beam Therapeutics | Cellectis SA | Sangamo Therapeutics | Precision BioSciences |
| 심볼 | CRSP | EDIT | NTLA | BEAM | CLLS | SGMO | DTIL |
| 현재 주가 | $153.11 | $70.11 | $54.40 | $81.64 | $27.06 | $15.60 | $8.34 |
| 시가 총액 | $10.90B | $4.37B | $3.51B | $4.73B | $1.17B | $2.21B | $437.7M |
| 52주 최저-최고가 | $32.30 - $181.42 | $14.01 - $96.45 | $9.18 - $70.00 | $13.00 - $100.65 | $7.32 - $33.59 | $4.81 - $19.43 | $4.45 - $15.07 |
| 90일 평균 거래량 | 1,442,070 | 1,814,193 | 1,320,790 | 801,400 | 306,887 | 2,274,364 | 956,112 |
| 상장일 | 2016년 10월 | 2016년 2월 | 2016년 5월 | 2020년 2월 | 2015년 3월 | 2000년 4월 | 2019년 3월 |
| 직원수 | 304 | 208 | 270 | 166 | 253 | 354 | 223 |
| R&D 비용1 | $233.3M | $131.3M | $143.9M | $90.9M | $94.0M | $166.6M | $91.8M |
| 영업 지출1 | $313.1M | $200.0M | $186.3M | 118.4M | $134.9M | $231.9M | $130.2M |
| 현금 및 현금성 자산 | $1.37B | $495.3M | $407.9M | $202.2M | $281.8M | $648.8M | $104.1M |
| 지속 가능 햇수2 | 4년 | 2.5년 | 2년 | 2년 | 2년 | 2.5년 | 1년 |
| 기관 보유 지분 | 68.4% | 82.2% | 85.7% | 65.5% | 33.9% | 58.7% | 50.3% |
| 임상 3상 | 0 (1)3 | ||||||
| 임상 1/2상 | 5 | 2 | 2 | 6 | 2 (2)3 | 3 | |
| 2021 시작 예정 | 1 | 1 | 2 | 1 | 2 | 1 | |
| 파트너십 | Vertex Pharma, Bayer | Bristol Myers Squibb | Regeneron, Novartis | Servier, Allogene, Iovance | Biogen, Gilead Sciences, Novartis, Pfizer, Sanofi, Takeda | Servier, Gilead Sciences, Elli Lilly |
출처: 필자 자체 제작 (1최근 12개월; 2현금 및 현금성 자산과 영업 지출 비교로 산출; 3괄호 안은 유전자 편집이 아닌 프로그램)
투자 포인트, 리스크 요인, 투자의견
유전자 편집 기업들에 대한 투자 포인트는 한마디로 ‘때가 무르 익었다’ 라고 표현할 수 있다. Sangamo Therapeutics를 제외한 유전자 편집 기업들은 최근 5년 내에 상장했는데 모두 전임상 단계에서 상장했다. 전임상 단계에서의 상장은 2020년 IPO 붐이 일면서 흔해졌으나 이전까지는 그리 흔한 일은 아니었다. 2020년 상장한 Beam Therapeutics를 제외하면 모든 기업이 2020년을 기준으로 임상 단계가 되었고 2021년부터는 본격적으로 임상시험 결과들을 내놓기 시작한다. 각 기업 소개에서 언급했듯 2021년은 유전자 편집 분야에서 촉매제가 가득한 한 해인 것이다. 물론 임상 시험 결과는 좋을 수도 있고 나쁠 수도 있다. 이를 예측하는 것은 쉽지 않다. 그러나 기존의 치료 방법과 비교해 여러 장점들이 존재하기 때문에 기존 치료법과 유사한 정도의 효능만을 보여준다고 해도 시장은 크게 실망하지 않을 것이다. 하나의 프로그램이 실패해도 또다른 프로그램을 만들어낼 수 있는 플랫폼 기업들이라는 점은 커다란 경제적 해자로 작용할 수 있다. 아직 언급하기에는 이르지만 세포 치료제는 복제약의 개발이 사실상 불가능한 분야다. 따라서 장기적인 안목으로 봤을 때 개발에 성공한다면 큰 경제적 해자를 지닐 수 있다.
리스크 요인은 유전자 편집 기업들이 개발중인 프로그램들이 모두 경쟁이 치열한 분야라는 점, FDA가 2020년 하반기부터 유전자/세포 치료제들에 대해 까다로운 심사를 하면서 눈높이가 높아진 점, (크리스퍼의 경우) 서로간에 얽혀있는 특허 분쟁, 그리고 높아진 밸류에이션 등이 있다.
유전자 편집 기업들의 주가는 서두에서 언급했듯 2020년 하반기들어 큰 폭으로 상승했다. 특히 크리스퍼 개발 기업들의 경우 다소 거품이 있다고 볼 여지가 있을 정도로 짧은 시간에 큰 폭으로 올랐다. 기업들의 시가 총액 역시 이제 임상 1상을 시작하거나 진행중인 기업들의 시가 총액으로 보기에는 너무 높은 수준으로 형성되어 있다. ㈜다만 유전자/세포 치료제들의 임상 1상은 일반 의약품의 임상 2상 정도로 봐야한다. 효능이 뛰어난 경우 임상 1/2상만으로도 승인 신청이 가능하다.
유전자 편집 기업들의 최근 5년 주가 추이
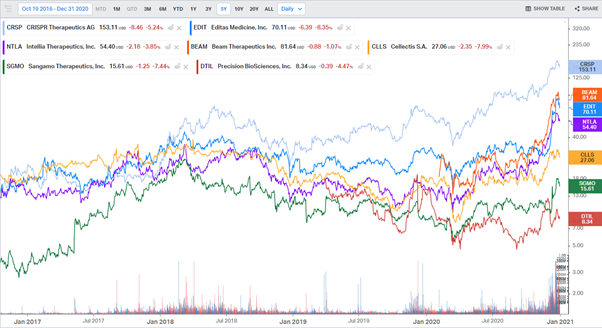
출처: Koyfin.com, 2021.1.3.
크리스퍼 기업들과 비교했을 때 탈렌, ZFN, 메가 핵산 분해 효소 기업들의 주가는 상대적으로 저렴하다. 특히 Sangamo Therapeutics의 경우 임상 3상 프로그램도 진행중이고 글로벌 대형 제약-바이오 기업들과의 파트너십도 다수 보유하고 있다는 점에서 매력적이다. 한편으로는 복수의 글로벌 대형 제약-바이오 기업들이 크리스퍼 보다는 ZFN을 선택하고 있다는 점도 주목할 만하다.
임상 단계의 바이오테크 기업의 주가는 변동성이 심하다. 특별한 이벤트가 없는 날에도 5-10%의 주가 등락은 흔하게 나타나고 임상시험 결과 발표와 같은 촉매제가 될만한 이벤트가 발생시에는 하루 50% 내외의 변동도 쉽게 볼 수 있다. 이벤트가 가까워 오면 주가가 상승 트렌드를 타고 반대로 이벤트 발생 후 다음 이벤트까지 상당 기간 남아있는 경우 주가는 하락 트렌드를 탄다. 이와 같은 특징들을 잘 파악해 본문에 소개한 이벤트들에 맞춰 매수/매도를 진행하면 도움이 될 것이다.
유전자 편집에 대해 신규로 투자를 하고 싶은 투자자라면 하나의 기업을 선택하기 보다는 복수의 서로 다른 플랫폼 기업을 바스켓으로 전체 포트폴리오의 5% 안쪽에서 담는 것을 추천한다. 유전자 편집 기업들은 상호간에 경쟁 관계이면서도 동반 관계에 있어 한 기업의 호재로 동일한 플랫폼 기업들의 주가가 같은 방향으로 움직이는 경향이 있다. 따라서 복수의 기업을 포트폴리오에 담는다고 헷징 역할을 하지는 못하다. 하지만 하나의 기업이 그 기업만의 악재로 크게 하락할 경우의 리스크를 막아줄 수 있다.
주가 측면에서 크리스마스 이후 조정을 받으면서 상당 부분 과매수 상태가 해소됐지만 JP 모건 헬스케어 컨퍼런스라는 대형 이벤트로 인한 바이오의 모멘텀이 살아있고 올 한 해 다수의 임상 결과 발표들이 예정되어 있다. 따라서 올 한 해 상당한 변동성을 보일 것으로 예상된다. 매수시에는 한 번에 담기 보다 시간을 두고 저가 분할 매수하면서 평균 단가를 낮춰가는 방법을 추천한다. 변동성을 이길 수 있는 가장 좋은 방법은 주식을 최대한 싸게 사는 것이다.
기존 보유자라면 대부분이 상당한 수익 구간에 있을 것이다. 본인의 투자 철학 및 변동성을 견딜수 있는 정도에 따라 장기 투자자는 하락시 추가 매수를, 중단기 투자자는 차익실현을 하는 것도 좋을 것이다.
'외부 기고글' 카테고리의 다른 글
| 유럽의 항체 플랫폼 강자 Genmab A/S (0) | 2022.09.11 |
|---|---|
| 뒤쳐진 백신 개발, 전화 위복의 계기가 될 것인가? Novavax (0) | 2022.09.11 |
| 2021년에는 인수될까? Incyte Corporation (0) | 2022.09.11 |
| 기업 IR 사이트 활용하기 (0) | 2022.09.11 |
| 생명과학 산업의 성장과 함께 간다 – 생명과학 서비스의 선두 기업 Thermo Fisher Scientific (0) | 2022.09.11 |
