ASH 2019 정리 (2019-12-11)
미국 혈액학 학회가 플로리다 올랜도에서 12/7~10일간 열렸습니다. 이번 학회에서 혈액암 및 혈액질환 관련 데이타들이 쏟아졌는데, 최근 연일 불마켓인 바이오 섹터의 분위기를 반영한듯 아주 초기 데이타라도 어느 정도 효과만 나오면 주가가 급등하는 등 조금 과열된 모습을 보여주고 있습니다. 지난 봄과 가을의 ASCO, ESMO 때는 바이오 주가가 좋지 않았던 것과는 조금 대조되는 모습입니다. 나름대로 이번 ASH의 하이라이트들이라고 생각되는 임상 데이타들을 모아봤습니다만, 가급적 초기 데이터 발표는 뺐습니다. 가령 Fate의 결과 같은 경우 환자 한명의 데이타와 전임상 데이타만 발표했음에도 iPSC driven NK 세포 치료의 첫 성과라는 점에서 주가가 크게 상승했는데, 아직은 논할 단계는 아닌듯 싶어 포함시키지 않았습니다. 또 데이타 방출이 너무 많았어서 제가 관심있게 본것 만 올립니다. 내용이 좀 깁니다.
[CD19 CAR-T]
Bristol-Myers Squibb (BMY, BMYRT), Gilead Sciences (GILD): BMY의 CD19 CAR-T인 lisocabtagene maraleucel (liso-cel)의 diffused large B-cell lymphomas (DLBCL) 4차 치료에 대한 pivotal 임상 1상 TRANSCEND NHL 001이 primary (ORR)와 secondary enpoints를 충족했습니다. BMY는 올해 안에 BLA를 제출할 예정입니다. liso-cel은 Celgene이 2017년 Juno를 인수하면서 들여온 CAR-T 치료제로 liso-cel의 FDA 승인은 BMY가 Celgene을 인수하면서 발행한 CVR에 포함된 세가지의 조건 중 하나이고 2020/12/31까지 승인을 받아야 합니다. Evaluate Pharma에서는 liso-cel이 안전성 면에서는 Yescarta 대비 우월성을 보였지만 최근 CRS 매니징 방법들이 많이 개발됐고, 효능 면에서는 더 낫다고 말하기 어려운데다가, 안전성 향상을 위해 제조 공정상 CD4/CD8 비율을 조절하는 스텝이 하나 더 들어가면서 제조상 시간과 난이도가 증가했고, 그덕에 제조 실패율이 올라갔다면서 FDA 입장에서 세번째 CAR-T를 서둘러서 승인할 필요성을 못느낄 거라고 부정적인 의견을 냈습니다. 반면에 BoA에서는 Best in Class라면서 아주 긍정적인 평가를 내놨네요.
한편 Gilead Sciences도 Yescarta의 DLBCL에 3차 치료에 대한 ZUMA-1 3년 데이타를 발표했습니다. Yescarta는 2017년 DLBCL의 3차 치료제로 FDA 승인을 받았습니다. 이번 3년 follow-up에서의 mOS는 25.8개월이었습니다. 또한 이번 발표에서는 CRS 매니징에 대한 연구결과도 같이 발표했습니다. Novartis의 Kymriah 역시 2018년 DLBCL의 3차 치료제로 확장 승인을 받았지만 second in market에다가 Yescarta 대비 효능, 안전성 모두 뒤져서 큰 영향은 없을듯 합니다. 이번 ASH에 Kymriah 발표는 없었습니다.
| | Bristol-Myers Squibb | Gilead Sciences | Novartis |
| 임상시험 | TRANSCEND NHL 001 | ZUMA-1 | JULIET |
| CAR-T | liso-cel | Yescarta (2017 승인) | Kymriah (2018 승인) |
| N | 256 | 101 | 106 |
| Minimum Follow-up (개월) | | 36 | |
| ORR | 73% (187/256) | 82% | 54% |
| CR | 53% (136/256) | 54% | 40% |
| mDOR (개월) | 12개월째 미도달 | | |
| mPFS (개월) | 6.8 | 5.9 | <3 |
| mOS (개월) | 21.1 | 25.8 | 11.1 |
| TEAE, Grade 3 or higher | 79% (213/269) | | |
| Neutropenia | 60% (161/269) | | 25% |
| Anemia | 38% (101/269) | | |
| Thrombocytopenia | 27% (72/269) | | 40% |
| CRS, any grade | 42% (113/269) | 94% | 74% |
| CRS, Grade 3 or higher | 2% (6/269) | 13% | 23% |
| 신경독성 | 30% (80/269) | 87% | 58% |
| 신경독성, Grade 3 or higher | 10% (27/269) | 31% | 18% |
| Death related to Tx | 4 | | |
| Death unrelated to Tx | 5 | | |
BMY는 liso-cel의 재발성/저항성 만성 림프구성 백혈병과 소림프구 림프종 (relapsed or refractory chronic lymphocytic leukemia or small lymphocytic lymphoma, CLL/SLL)에 대한 임상 1/2상TRANSCEND CLL 004과 골수이식이 불가능한 재발성/저항성 큰B세포 비호지킨 림프종 (relapsed or refractory large B-cell non-Hodgkin’s lymphoma, NHL)에 대한 임상 2상 PILOT, 그리고 재발성/저항성 큰B세포 비호지킨 림프종의 외래병원 치료 데이타도 공개했습니다.
| | TRANSCEND CLL 004 | PILOT | 외래병원 치료 |
| N | 22 | 13 (안전성), 12 (효능) | 44 |
| Median Prior line Tx | 5 | 1 | |
| Dose | 50 x 10^6, 100 x 10^6 | 100 x 10^6 | |
| Median Follow-up (개월) | 11 | | |
| ORR | 18 (81.8%) | 12 (100%) | 35 (80%) |
| CR | 10 (45.5%) | 6 (50%) | 24 (55%) |
| >Grade 3 TEAE | 22 (96%) | 8 (61.5%) | |
| CRS | 17 (74%) | 3 (23%) | 17 (39%) |
| >Grade 3 CRS | 2 (9%) | 0 | 1 (2%) |
| 신경독성 | 9 (39%) | 0 | 13 (30%) |
| >Grade 3 신경독성 | 5 (22%) | 0 | 2 (5%) |
Gilead Sciences는 Yescarta의 두번째 적응증을 위한 재발성/저항성 외투세포림프종 (relapsed or refractory mantle cell lymphoma, MCL)에 대한 임상 2상 ZUMA-2의 결과를 발표했습니다. Median follow-up 12.3개월에서 ORR 93%, CR 67%, mDOR, PFS, OS는 아직 도달하지 않았고 12개월 PFS 61%, OS 81%를 보였습니다. CRS와 신경독성은 각각 91%, 63%, Grade 3 이상의 CRS와 신경독성은 각각 15%, 31%, Grade 5 이상은 없었습니다. Gilead는 이번 결과를 바탕으로 올해 안에 sBLA를 FDA에 신청하고 2020년 1분기에 EC에 MAA를 신청할 계획입니다.
Precision BioSciences (DTIL): CAR-T 후보물질 PBCAR0191의 임상 1상 r/r NHL 코호트의 데이타가 공개됐습니다. PBCAR0191는 환자의 T세포를 분리해서 유전자 조작과 배양을 통해 만들어내는 autologous CAR-T와 달리 건강한 성인에게서 미리 추출하여 유전자 조작과 배양을 거쳐 바로 투여 가능하도록 제조된 off-the-shelf CAR-T입니다. 공개된 데이타에서 ORR 66% (4/6), CR 16.7% (1/6)의 반응률을 보였지만 두명의 PR 환자의 질병이 악화됐고 r/r B-cell ALL 환자에서는 ORR 33% (1/3, CR)의 반응률을 보였습니다. 안전성에서는 off-the-shelf CAR-T의 문제점인 이식거부반응 (GvHD)는 보이지 않았고 생명에 위협이 될만한 부작용이 한건 보고됐습니다. 발표 후 기존 1세대 CAR-T 대비 떨어지는 효능에 실망한 매물이 출회되면서 50% 하락했습니다.
[CD20 bispecific]
Roche (RHHBY): Roche가 두개의 CD20, CD3 이중항체 mosunetuzumab과 CD20-TCB의 결과를 발표했습니다. Mosunetuzumab은 Tecentriq과 병용 혹은 단독으로 이전 치료에 실패한 재발성/저항성 비호지킨 림프종 (relapsed or refractory B-cell non-Hodgkin’s lymphoma, r/r NHL) 혹은 만성 림프구성 백혈병 (chronic lymphocytic leukaemia, CLL)에 대한 임상 1/1b상 GO29781을 진행중이고 CD20-TCB는 Gazyva (obinutuzumab)와 병용으로 r/r NHL에 대한 임상 1/1b상 NP30179를 진행중입니다. Mosunetuzumab은 r/r NHL에 대한 단독 투여 결과를 발표했습니다. 결과는 아래 표와 같습니다. Mosunetuzumab의 CAR-T 치료에 실패한 환자에 대한 결과가 주목되는데 지금까지 CAR-T 치료에 실패한 환자에게는 더이상의 치료 옵션이 없다고 여겨져 왔기 때문입니다.
| GO29781 | Slow-growing NHL | Aggressive NHL | CAR-T치료 실패 | Total |
| ORR | 62.7% (42/67) | 37.1% (46/124) | 38.9% (7/18) | 34.6% (66/191) |
| CR | 43.3% (29/67) | 19.4% (24/124) | 22.2% (4/18) | 21.5% (41/191) |
| CRS | | | | 28.9% (Grade 1 20.0%, Grade 31.1%) |
| Grade 3신경독성 | | | | 3.7% |
| NP30179 | Folicular Lymphoma | Aggressive NHL | Total |
| ORR | 66.7% (4/6) | 50% (11/22) | 54% (15/28) |
| CR | 66.7% (4/6) | 40.9% (9/22) | 46% (13/28) |
| CRS | | | 67.9% (19/28) |
Xencor (XNCR): Xencor도 이중항체 XmAb13676 (CD20 x CD3)의 r/r NHL, r/r CLL에 대한 dose escalating 임상 1상 결과를 발표했습니다. 이중 diffuse large B-cell lymphoma (DLBCL)의 효능 데이타가 발표됐습니다. 효능은 dose dependency를 보였고 ORR 39% (7/18) CR 28% (5/18)의 반응률을 보였습니다.
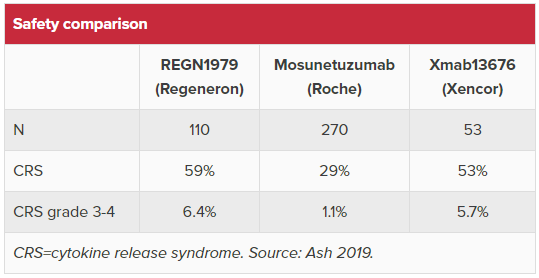
Regeneron Pharmaceuticals, Inc. (REGN): Regeneron도 이중항체 REGN1979의 임상 1상 결과를 발표했습니다. REGN1979는 작년 ASH에서 높은 효능으로 관심을 받았지만 환자가 사망할 정도로 독성도 강해서 임상 중단 명령도 받은적이 있습니다. 아래 표는 Evaluate Pharma에서 REGN1979와 mosunetuzumab의 효능, XmAb13676을 포함한 안전성을 비교해 놓은 표입니다. REGN1979는mosunetuzumab 대비 효능에서는 뛰어나지만 안전성에서는 떨어지는 것 같습니다. XmAb13676은 아직 너무 일러서 논하기 어려운듯 합니다.

[BCMA CAR-T]
이번 ASH에서 가장 주목을 받았던 분야 중 하나가 BCMA를 타게팅하는 CAR-T와 이중항체들입니다. 이중항체 중 가장 앞서있는 GSK의 ADC belantamab mafodotin (GSK2857916)는 이번 학회에서 발표가 없었고, 작년 ASH에서 주목을 끈 Amgen의 이중항체 AMG 420 역시 발표가 없던 가운데 JNJ, bluebird/ BMY, Regeneron/Sanofi가 후보물질의 첫 데이타를 공개했습니다.
Johnson & Johnson (JNJ), Legend Biotech, bluebird bio, Inc. (BLUE), Bristol-Myers Squibb (BMY, BMYRT): BCMA CAR-T JNJ-68284528 (JNJ-4528)의 재발성/저항성 다발성 골수종 (relapsed or refractory multiple myeloma, r/r MM) 4차 치료에 대한 임상 1b/2상 CARTITUDE-1에서 100% ORR, CR은 69%을 보였습니다 (n=29). 또한 100%의 환자들이 투여 28일만에 MRD 음성을 보였습니다. 부작용은 CRS 93%, 호중구 감소증 (neutropenia) 93%, 빈혈 (anemia) 86%, 혈소판 감소증 (thrombocytopenia) 86%이고 Grade 3 이상 부작용은 25%입니다. 한명의 환자가 Grade 5 CRS로 사망했습니다. JNJ-4528은 개발 파트너인 중국의 Legend Biotech에서 개발한 LCAR-B38M과 동일한 BCMA를 타게팅하는 두개의 single domain 항체로 만들어진 CAR-T입니다. Legend Biotech이 별도로 진행중인 LCAR-B38M의 중국에서의 임상시험 LEGEND-2에서는 ORR 88%, CR 46%, mPFS 20개월을 보였습니다. 지난주에 결과를 발표한 BCMA CAR-T중 가장 앞서있는 bluebird bio/BMY의 ide-cel (bb2121)의 임상 2상 KarMMa에서 가장 효능이 높게 나타난 최고용량군의 결과와 비교했을때 앞서는 결과입니다. 특히 PFS에서 큰 차이를 보이는 점에서 추후 OS에서 역시 차이를 보일 가능성이 높고, ide-cel이 승인은 무난히 받고 first mover advantage를 누리기는 하겠지만 그리 오래 가지는 못하지 않을까 싶네요. 다만 안전성 면에서는 bb2121이 조금 앞서는듯 합니다. bb2121의 승인은 BMY의 CVR 세가지 조건 중 또다른 하나입니다.
bluebird bio/BMY는 이번 ASH에서는 ide-cel (bb2121) 대신 bb21217의 r/r MM에 대한 임상 1상 데이타를 발표했습니다. bb21217은 bb2121을 PI3 kinase 저해제 bb007와 함께 배양해서 메모리 T세포수를 늘려서 세포 배양시 CAR-T를 늘리도록 디자인한 CAR-T입니다. 150, 300, 450 x 10^6 용량을 테스트중인 이번 임상시험에서 ORR 61% (20/33), CR 15%를 보였는데 고용량군의 데이타는 아직 분석하기 이른것 같고 저용량군에서는 ORR 83%, CR 33%를 보였습니다.
| | Johnson & Johnson | Legend Biotech | bluebird bio | bluebird bio |
| CAR-T | JNJ-68284528 (JNJ-4528) | LCAR-B38M | ide-cel (bb2121) 고용량군 | bb21217 |
| 임상시험 | 1b/2상 CARTITUDE-1 | 1/2상 LEGEND-2 | 2상 KarMMa | 1상 CRB-402 |
| N | 29 | 57 | 54 | 12 (저용량군) |
| Prior line of Tx | >=3, median 5 | | >=3 | >=3, median 6 |
| ORR | 100% | 88% | 81.5% | 83% |
| CR | 69% | 74% | 35.2% | 33% |
| mDOR (개월) | | 22 | 11.3 | 11.1 |
| mPFS (개월) | 미도달 (6개월) | 20 | 11.3 | |
| CRS | 93% | 90% | 83.6% (전체환자군) | 66% (전체환자군) |
| >Grade 3 CRS | 25% | 7% | 5.5% (7/128, 전체환자군) | 5% (전체환자군) |
| 신경독성 | 10% | | 83% (전체환자군) | 24% (전체환자군) |
| 신경독성 >Grade 3 | 3% | | 3% (전체환자군) | 8% (전체환자군) |
| 사망 | 1 | 0 | 1 | 1 |
[BCMA bispecific]
작년 ASH에서 큰 화제를 모았던 후보물질 중 Amgen의 BCMA x CD3 이중항체 AMG 420이 있습니다. BCMA CAR-T가 이번 ASH에서도 핫한 토픽인 가운데 작년 ASH에서는 AMG 420이 BCMA CAR-T를 대체할 후보물질로 주목을 받았었습니다. BCMA x CD3의 이중항체는 Regeneron/Sanofi, Bristol-Myers Squibb, Pfizer, JNJ/Genmab (JNJ-7957)에서도 개발중입니다. 이번 ASH에서 Regeneron/Sanofi의 REGN5458, BMY의 CC-93269, Pfizer의 PF-0683135의 첫 데이타 공개가 있었습니다.
Regeneron Pharmaceuticals, Inc. (REGN), Sanofi (SNY): REGN5458의 r/r MM에 대한 임상 1상에서 고용량 6 mg 그룹에서 75%의 ORR을 보였습니다. 제가 작년 Amgen의 발표 자료를 press release 밖에 못찾아서 정확한 비교는 좀 어렵지만 AMG 420의 400 ug/D 그룹의 70% ORR과 비견되는 수치입니다. 다만 아직 환자수에서 좀 차이가 납니다. 주목할만한 점은 투여스케쥴과 안전성입니다. 작년 AMG 420의 경우 효능 면에서는 모두들 놀랍게 여겼지만 Amgen의 이중항체 플랫폼 BiTE이 항체 의 항원 결합 부위만 떼서 링커로 이어붙인 작은 분자량의 단백질이라 반감기가 너무 짧아서 병원에 입원해서 링겔꽂고 4주간 연속 투여를 해야하고 이런 사이클을 세번을 반복해야한다는 단점이 있었습니다. REGN5458의 경우에는 일반 항체 의약품과 동일한 반감기이기 때문에 초기 1주에 한번, 이후 2주 한번 투여 사이클로 가능합니다. 또한 AMG 420, 여타 BCMA CAR-T들의 가장 큰 문제점 중 하나인 Grade 3 이상의 CRS와 신경독성이 보고되지 않았습니다. 아마도 용량을 조금 더 올릴 여지가 있지 않을까 싶네요. 한편 Amgen은 AMG 420의 반감기를 개선시킨 AMG 701의 전임상 결과를 발표했는데 AMG 420의 전임상과 비견될만한 결과가 나온듯 합니다.
Bristol-Myers Squibb (BMY): BMY도 삼중 항체 CC-93269의 첫 데이타 공개가 있었습니다. CC-93269는 하나의 arm에 BCMA와 CD3 결합부위를 지니고 다른 하나의 arm에는 다른 BCMA 결합부위를 지닌 ‘2+1’ 구조의 이중 항체입니다. CC-93269은 최고용량 10 mg 투여군에서 ORR 88.9%, CR 44.4%의 우수한 효능을 보였지만 CRS가 다소 높게 나타나는 단점을 보였습니다. REGN5458과 마찬가지로 신경독성은 보고되지 않았습니다.
Pfizer (PFE): Pfizer의 PF-0683135의 경우 dose escalating study 중 저용량 데이타만 발표했는데 치료효과는 ORR 6% (1/16)으로 극히 미미합니다. 추후 추적기간이 더 길어지고 고용량 데이타가 나와봐야 비교가 가능할 것 같습니다.
| 회사명 | Regeneron/Sanofi | Bristol-Myers Squibb | Amgen (ASH 2018) |
| 후보물질 | REGN5458 | CC-93259 | AMG 420 |
| Modality | Full human bispecific antibody | 2 x BCMA + 1 CD3 | Bispecific T-cell engager (BiTE) – No Fc portion |
| 투여 스케쥴 | IV infusion, 1주일 한번 x 16 회, 2주일 한번 x 12회, 3 mg or 6 mg | IV infusion, 4주간 1주일 한번 x 3회, 4주간 2주 한번 x 3회, 4주 한번 x 1회, 2년간, 0.15 mg~10 mg | (4주간 연속 IV 투여, 2주 break) x 3 사이클 |
| N | 7 (3 x 3 mg, 4 x 6 mg) | 30 | 42 |
| Prior line of Tx | 3 (median 7) | 3 (median 5) | 2 |
| ORR | 4 (57%), 6 mg 3/4 (75%) | 0% (<3 mg), 35.5% (3-6 mg) 88.9% (10 mg) | 13 (31%), 400 ug/D 7/10 (70%) |
| CR | 1 (2 very good PR) | 44.4% (10 mg) | 7 |
| MRD negative | 2 (50% of responders) | 92.3% of responders | |
| > Grade 3 TEAE | 5 (71%) | 22 (73.3%) | |
| CRS | 3 (43%) | 23 (76.7%) | |
| CRS, > Grade 3 | 0 | 1 (3.3%) | |
| CRS death | 0 | 1 | |
| 신경독성 | 0 | 0 | |
[BTK inhibitor]
이번 ASH에서 BTK 저해제들의 경쟁도 치열했습니다. 혈액암 치료제인 BTK 저해제는 Imbruvica (AbbVie/J&J), Calquence (AstraZeneca), 그리고 최근 FDA 승인을 받은 Brukinsa (BeiGene)가 대표적인데 내성을 지닌 C481S가 자주 발생합니다. 이를 극복하기 위한 2세대 BTK저해제들이 개발되고 있고 아래 따로 묶어놨습니다.
AstraZeneca (AZN): AstraZeneca는 Calquence 단독 혹은 Gazyva (obinutuzumab, CD20 항체, Roche)과의 병용의 만성 림프구성 백혈병 (CLL) 1차 치료에 대한 임상 3상 ELEVATE TN에서 표준치료인 화학요법, Gazyva 병용 대비 높은 PFS과 ORR을 보였습니다. Calquence는 지난 11월 CLL 1차 치료제로 FDA 승인을 받았습니다.

TG Therapeutics (TGTX): BTK 저해제 TG-1701의 단독 혹은 U2 (umbralisib, 경구용 PI3K/CK1e 이중 저해제, ublituximab, CD20 항체)와의 3중 병용요법의 재발성/저항성 비호지킨 림프종 (relapsed or refractory non-Hodgkin’s lymphoma, r/r NHL) 과 만성 림프구성 백혈병 (chronic lymphocytic leukaemia, CLL)에 대한 임상 1상의 첫 데이타를 발표했습니다. 100mg~400mg의 dose escalation study인 단독요법에서 다양한 B세포 종양들 - mantle cell lymphoma (MCL), chronic lymphocytic leukemia (CLL), Waldenström's macroglobulinemia (WM), small lymphocytic lymphoma (SLL)에 걸쳐 여러 용량에서 PR 반응을 보였습니다 (n=21). 3중 병용에서는 저용량 (100 mg)의 TG-1701 데이타만 발표됐는데 follicular lymphoma (FL), marginal zone lymphoma (MZL), Waldenström's macroglobulinemia (WM), diffuse large B-cell lymphoma (DLBCL)에 걸쳐 ORR 86%, DCR 100%의 반응률을 보였습니다.
| | ORR | CR | DCR |
| FL | 75% (3/4) | 50% (2/4) | 25% (1/4) |
| MZL | 100% (1/1) | 0% | 100% (1/1) |
| WM | 100% (1/1) | 0% | 100% (1/1) |
| DLBCL | 100% (1/1) | 0% | 100% (1/1) |
| Total | 86% (6/7) | 29% (2/7) | 100% (7/7) |
Principia Biopharma (PRNB): 면역성 혈소판 감소증 (immune thrombocytopenia)에 대한 리드후보물질 PRN1008의 임상 1/2상에서 primary endpoint인 혈소판 카운트 50,000/uL, 베이스라인으로부터 20,000/uL이상 증가를 모든 dosing arm의 환자들 중 39%에서 충족했습니다.
[Non-covalent BTK inhibitor]
ArQule, Inc. (ARQL): 현재 2세대 BTK 저해제 그룹의 선두주자는 ArQule의 ARQ 531입니다. 이번 발표에 앞서 Merck의 인수 발표가 나기도 했습니다. 현재 진행중인 임상 1상에서 BTK-C481S 돌연변이를 지닌 r/r CLL에서 ORR 89% (8/9, 반응 8명중 7명이 C481S 돌연변이 보유자)를 보였고 Richter’s Transformation에서는 ORR 50% (3/6)의 반응률을 보였습니다. FL (1/3)과 DLBCL (1/1)에서도 PR을 보였습니다.
Eli Lilly and Company (LLY): ARQ 531의 뒤를 쫓고 있는 Lilly의 경구용 2세대 BTK 저해제 LOXO-305의 BTK저해제, BCL2 저해제 치료가 실패한 환자들을 포함한 CLL, MCL, Waldenstrom macroglobulinemia, DLBCL, MZL에 대한 임상 1/2상 BRUIN에서CLL ORR 77% (10/13) DCR 100% (13/13), MCL ORR 50% (3/6)의 반응률을 보였습니다.
Aptose Biosciences (APTO): Non-covalent BTK 저해제의 또다른 주자인 Aptose의 경우 이번 학회에서 후보물질 CG-806의 in vitro 데이타만 발표했습니다. CG-806은 FLT3/BTK 이중 저해제로 한국의 CrystalGenomics로부터 라이선싱한 물질입니다. 임상 데이타는 없었지만 ArQule의 인수 발표에 힘입어 주가는 크게 상승했네요.
[기타 항암제]
TG Therapeutics (TGTX): TG Therapeutics가 재발성/저항성 만성 림프구성 백혈병 (chronic lymphocytic leukaemia, CLL)에 대한 umbralisib (경구용 PI3K/CK1e 이중 저해제), ublituximab (CD20 항체), Venclexta (venetoclax, Bcl-2 저해제, Roche & AbbVie) 3중 병용의 임상 1/2상 첫 데이타를 공개했습니다. 총 23명의 효능 평가가 가능한 환자들에서 umbralisib과 ublituximab (U2)만의 3번의 유도 사이클 후 87% (20/23)의 ORR을 보였고 4번째 사이클 이후 Venclexta 이 추가된 총 7번의 투여 사이클을 종료한 13명의 환자에서100% ORR (13/13)을, 총 12번의 사이클 (12개월)을 종료한 9명의 환자에서 100% ORR (9/9)과 44% CR (4/9)을 보였습니다. 이 12명의 환자들은 100% 말초혈관 MRD 음성과 78% (7/9) 골수 MRD 음성을 보였습니다.
Portola Pharmaceuticals (PTLA): Portola가 경구용 SYK/JAK 저해제 cerdulatinib의 두개의 임상 2a상 결과를 발표했습니다. 첫번째 임상시험은 T세포 비호지킨 림프종 (T-cell Non-Hodgkin Lymphoma)의 하위분류인 재발성/저항성 주변 T세포 림프종 (relapsed/refractory peripheral T-cell lymphoma, PTCL), PTCL의 하위분류인 혈관면역모구T세포림프종 (angioimmunoblastic T-cell lymphoma, AITL), 피부T세포림프종(cutaneous T-cell lymphoma, CTCL) 등 희귀 혈액 종양에 대한 임상시험이고 두번째 임상시험은 재발성/저항성 여포성 림프종 (relapsed/refractory follicular lymphoma, FL)에 대한 임상시험입니다. FL에 대한 임상시험은 단독 혹은 rituximab (anti-CD20, Roche)와의 병용으로 진행됐습니다.
| | PTCL | AITL | CTCL | FL (단독) | FL (+rituximab) |
| N | 64 | 27 | 40 | 42 | 21 |
| ORR | 22 (34%) | 14 (51%) | 17 (43%) | 20 (48%) | 16 (76%) |
| CR | 14 (22%) | 10 (37%) | 3 (8%) | 7 (17%) | 5 (24%) |
| SD | | | | 10 (24%) | 5 (24%) |
| mDOR (개월) | 8 | >9 | | | |
Epizyme (EPZM): 여포성 림프종 follicular lymphoma (FL)에 대한 EZH2 저해제 tazemetostat의 임상 2상 결과를 발표했습니다. EZH2 돌연변이를 지닌 환자군에서 ORR 69%, DCR 98% 높은 효능을 보였습니다. Epizyme은 FL에 대해서 이달 안에 FDA에 신속 승인으로 심사 신청을 할 계획입니다. 현재 tazemetostat은 상피모양육종 (epithelioid sarcoma)에 대해 FDA 승인 심사중이고 AdCom은 12/18, PDUFA는 2020/1/23 입니다.
| | EZH2 mutation | EZH2 wild type | Total |
| N | 45 | 54 | 99 |
| ORR | 31 (69%) | 19 (35%) | 50 (51%) |
| CR | 6 (13%) | 2 (4%) | 8 (8%) |
| SD | 13 (29%) | 18 (33%) | 31 (31%) |
| DCR | 44 (98%) | 37 (69%) | 81 (82%) |
| mPFS (개월) | 13.8 | 11.1 | |
| mDOR (개월) | 10.9 | 13.9 | |
Agios Pharmaceuticals (AGIO): Tibsovo (ivosidenib)와 화학요법 azacitidine (Vidaza, Celgene) 병용의 IDH1 돌연변이를 지닌 AML 1차 치료에 대한 임상 1/2상에서 CR 61% (14/23)의 반응률을 보였고 mDoR은 아직 이르지 못했습니다. Tibsovo는 단독으로 IDH1 돌연변이를 지닌 AML에 대해 승인 받았습니다.
Forty-Seven (FTSV): 유도 화학치료가 부가능한 골수형성 이상 증후군 (myelodysplastic syndromes, MDS)과 급성 골수성 백혈병 acute myelogenous leukemia, AML) 환자들에 대한 magrolimab과 azacitidine (Vidaza, Celgene) 병용의 1차 치료제에 대한 임상 1b상의 결과를 발표했습니다. Magrolimab은 Macrophage에서 발현되는 CD47을 타게팅하는 항체입니다.
| | MDS | AML |
| N | 35 | 27 |
| ORR | 92% (22/24) | 64% (14/22) |
| CR | 50% (12/24) | 41% (9/22) |
| DCR | 100% (24/24) | 95% (21/22) |
| mDOR | 미도달 | 미도달 |
| OS | 미도달 | 미도달 |
[빈혈 및 희귀질환]
bluebird bio, Inc. (BLUE): 유전자 치료제 LentiGlobin의 겸상적혈구 빈혈 (SCD)에 대한 임상 1/2상 HGB-206의 그룹 C 결과를 발표했습니다. Group C 환자들은 벡터 카피 넘버가 증가된 개선된 공정에서 만들어진 바이러스와 골수가 아닌 말초혈액 (peripheral blood)에서 채취된 조혈모세포로 만들어진 LentiGlobin을 수혈받은 그룹입니다. LentiGlobin은 환자의 조혈모세포를 채취해 non-sickling 헤모글로빈 유전자인 HbAT87Q를 Lentivirus를 통해 발현시킨 후 환자에 다시 투여하는 방식의 ex vivo 유전자 치료입니다. 데이타 컷오프까지 총 17명의 환자가 LentiGlobin 치료를 받았고 최장 follow-up은 21개월, 17명 모두 치료 후 적혈구 수혈을 하지 않고 있습니다. 최소 6개월 이상 follow-up 환자 12명의 헤모글로빈 수치는 아래 표와 같습니다 (2018년 ASH 데이타와 비교). 정상인의 적혈구 수치는 여성 12.0-15.5, 남성 13.5-17.5입니다. 지난 2년간 혈관막힘위기(vaso-occlusive crises, VOCs) 혹은 acute chest syndrome (ACS) 같은 증상을 4회 이상 겪은 9명의 환자들의 연간 발병률은 99% 감소했고 투여후 최대 21개월까지 증상이 나타나지 않았습니다. 한명의 환자에서 투여 후 3.5개월째 심각하지 않은 Grade 2 VOC가 나타났습니다. Group A와 B 환자들의 경우 7/9 환자 (A 5/7, B, 2/2)가 투여후 적혈구 수혈이 필요하지 않았고 완벽하지는 않았지만 VOC와 ACS의 감소가 나타났습니다. 임상 3상 HGB-210은 2020년에 시작할 예정입니다.
| | Group A | Group B | Group C | |||
| | 2018 | 2019 | 2018 | 2019 | 2018 | 2019 |
| N | 7 | 7 | 2 | 2 | 4 | 12 |
| Follow-up | Up to 39 months | > 3 years | Up to 14 months | 2 years | 6 months | 6~21 months |
| HbAT87Q (g/dL) | 0.7-2.8 | 0.9 (median) | 3.4, 6.5 | 3.6, 7.1 | 4.8-8.8 | 2.7-9.0 (40% of total) |
| Total Hemoglobin (g/dL) | 7.6-11.8 | 9.0 (median) | 11.0, 12.3 | 11.3, 13.0 | 9.9-13.7 | 9.3-15.2 |
blubird는 LentiGlobin의 지중해 빈혈에 대한 임상 1/2상 Northstar (HGB-204)의 롱텀 데이타와 임상 3상 Northstar-2 (HGB-207), Northstar-3 (HGB-212)의 결과도 발표했습니다.
| Northstar | β0/β0 비유전형 | β0/β0 유전형 |
| 추적기간 | 최대 51.3개월 | 최대 30.4개월 |
| 12개월 이상 적혈구 비수혈 | 80% (8/10) | 38% (3/8) |
| Median Hb (g/dL) | 10.3 | 9.9 |
| | Northstar-2 (HGB-207) | Northstar-3 (HGB-212) |
| 유전형 | 비 β0/β0 | β0/β0 혹은IVS-I-110 돌연변이 |
| 추적기간 (median, 개월) | 11.6 | 8.8 |
| 12개월 이상 적혈구 비수혈 | 90% (9/10) | 2/2 (100%) |
| Median Hb (g/dL) | 12.2 (11.4-12.8) | 13.2, 10.4 |
Bristol-Myers Squibb Company (BMY), Acceleron Pharma (XLRN): 최근 지중해 빈혈에 대해 FDA 승인을 받은 Reblozyl (luspatercept-aamt)의 골수 섬유증 (myelofibrosis) 환자의 빈혈에 대한 임상 2상 결과가 발표됐습니다. 수혈 의존성과 ruxolitinib 투여 여부에 따라 네개의 코호트로 나눠 진행된 임상시험에서 결과는 아래와 같습니다.
| | Cohort 1 | Cohort 3A | Cohort 2 | Cohort 3B |
| Criteria | 수혈 비의존적, ruxolitinib 비투여 | 수혈 비의존적, ruxolitinib 투여 | 수혈 의존적, ruxolitinib 비투여 | 수혈 의존적, ruxolitinib 투여 |
| Primary endpoint 충족 | 14% (3/22) | 21% (3/14) | 10% (2/21) | 32% (6/19) |
| 헤모글로빈 수치 최소 1.5 g/dL 증가 | 18% (4/22) | 64% (9/14) | | |
| 수혈 빈도 50% 이상 감소 | | | 38% (8/21) | 53% (10/19) |
Constellation Pharmaceuticals (CNST): Constellation Pharma가 골수 섬유증 (myelofibrosis)에 대한 리드 후보물질 CPI-0610 단독 혹은 ruxolitinib (Ijakafi, Incyte) 병용에 대한 임상 2상 MANIFEST의 결과를 발표했습니다. Ruxolitinib과의 병용 1차치료에서는 80% (12/15)의 환자에서 primary endpoint인 SVR35를 충족했고, 71% (10/14)의 환자는 TSS50을 충족했습니다. Ruxolitinib에 저항성을 보이는 환자에 대한 CPI-0610의 추가 치료에서는 SVR35 25% (3/12), TSS50 54% (7/13)을 보였고 43% (6/14)의 환자가 수혈 비의존성으로 전환했습니다. 안전성 면에서는 ruxolitinib을 투여한 환자군에서 3명의 환자가 치명적인 빈혈을, 1명의 환자가 치명적인 혈소판 감소증을 보였습니다. CPI-0610은 BET 저해제입니다.
Mustang Bio (MBIO): 일명 "Bubble Boy Disease"라 불리는 X-연계 중증 복합 면역 결핍증 (X-linked severe combined immunodeficiency, XSCID)에 대한 유전자 치료제 MB-107의 임상 1/2상을 진행하고 있는 Mustang Bio가 임상 결과를 발표했습니다. St. Jude Children's Hospital에서 진행되고 있는 임상시험에서는 9명의 두살 이하 유아에서 치료후 3-4주만에 조혈줄기세포가 복구되었고, 3-4개월 만에 정상적인 T세포와 NK세포 수치가 검출되었으며, 5명이 IV immunoglobulin therapy를 더이상 받지 않아도 되었고 이중 세명은 벡신에 반응을 보이는 등 긍정적인 결과가 나왔습니다. 그러나 NIH에서 진행중인 좀 더 나이가 많은 어린이들에 대해 조혈모세포이식 후의 구조요법 (salvage therapy)에 대한 임상시험은 바이러스의 세포전달이 비효율적으로 일어나면서 면역세포의 회복이 제대로 일어나지 않았습니다.
Sanofi's (SNY): Bioverativ를 인수하면서 편입한 sutimlimab (BIVV009)의 1차 저온 응집병 (primary cold agglutinin disease)에 대한 임상 3상 CARDINAL이 primary와 secondary endpoints를 충족했습니다. Primary endpoint인 26주 헤모글로빈 수치 증가와 5~26주 동안 수혈 부재에서 54% (13/24)가 충족했고, 63% (15/24)에서 헤모글로빈 수치 12 g/dL 이상이 검출됐으며, 83% (20/24)에서 임상적으로 유의미한 헤모글로빈의 증가가 검출됐습니다. Sutimlimab은 complement-specific serine protease enzyme C1s를 저해하는 항체입니다. Sanofi는 조만간 승인신청을 할 계획입니다.
Blueprint Medicines Corp. (BPMC): 진행성 전신성 비만세포증 (advanced systemic mastocytosis)에 대한 avapritinib의 임상 1상 EXPLORER에서 ORR 77% (37/48)을 보였습니다. 그러나 데이타 컷오프 이후 한명의 환자가 심각한 두개내 출혈 (fatal intracranial bleed)을 보이며 안전성에 문제를 드러냈습니다. Blueprint는 2020년 1분기에 FDA에 NDA를 제출할 예정입니다. Avapritinib은 c-Kit/PDGFRA 저해제입니다.
아래 표는 위에 언급된 종목들의 지난주 금요일 (6일) 대비 수요일 (10일)까지의 수익율입니다.
| Symbol | Name | Weekly Gain | 시가총액 |
| S&P500 (SPY) | SPDR S&P 500 ETF Trust | -0.43% | |
| Nasdaq100 (QQQ) | PowerShares QQQ Trust, Series 1 | -0.54% | |
| 바이오텍 (XBI) | SPDR S&P Biotech | 1.16% | |
| FTSV | Forty Seven Inc | 140.03% | 1.5B |
| ARQL | ArQule, Inc. | 106.52% | 2.4B |
| APTO | Aptose Biosciences Inc | 46.48% | 208.1M |
| FATE | Fate Therapeutics Inc | 38.33% | 1.4B |
| TGTX | TG Therapeutics Inc common stock | 32.30% | 937.9M |
| PRNB | Principia Biopharma Inc | 30.78% | 1.6B |
| AGIO | Agios Pharmaceuticals Inc | 8.09% | 3.0B |
| BLUE | bluebird bio Inc | 7.89% | 4.7B |
| SNY | Sanofi SA | 4.48% | 60.3B |
| BMY | Bristol-Myers Squibb Co | 3.57% | 145.6B |
| EPZM | Epizyme Inc | 3.24% | 1.7B |
| XLRN | Acceleron Pharma Inc | 1.16% | 2.7B |
| LLY | Eli Lilly And Co | 0.84% | 115.8B |
| AZN | AstraZeneca plc | 0.63% | 62.9B |
| PFE | Pfizer Inc. | 0.50% | 213.0B |
| AMGN | Amgen, Inc. | 0.03% | 138.9B |
| GILD | Gilead Sciences, Inc. | 0.00% | 84.9B |
| JNJ | Johnson & Johnson | -0.28% | 368.4B |
| RHHBY | Roche Holdings AG Basel ADR Common Stock | -0.44% | 263.9B |
| REGN | Regeneron Pharmaceuticals Inc | -1.23% | 39.7B |
| BGNE | Beigene Ltd | -2.43% | 88.1B |
| XNCR | Xencor Inc | -3.43% | 2.2B |
| PTLA | Portola Pharmaceuticals Inc | -4.59% | 2.2B |
| BPMC | Blueprint Medicines Corp | -9.42% | 3.5B |
| MBIO | Mustang Bio Inc | -15.32% | 132.2M |
| CNST | Constellation Pharmaceuticals Inc | -18.74% | 1.2B |
| DTIL | Precision BioSciences Inc | -51.27% | 486.5M |
'Archive > 학회정리' 카테고리의 다른 글
| ASCO 2018 Day 1 & Day 2 : 네이버 블로그 (2018/6/4) (0) | 2020.01.14 |
|---|---|
| ESMO 2019 정리 (2019-10-2) (0) | 2019.12.16 |
| ASCO 2019 정리 (2019-6-6) (0) | 2019.12.16 |
