ESMO 2019 정리 (2019-10-2)
ISM 제조업 지수의 부진으로 시장이 크게 흔들린 하루였습니다. 매크로 상황이 안좋아지는 상황에서 임상시험결과 따위가 뭐가 중할까 싶기는 합니다만.. 이번주에는 유럽 종양학회 (ESMO)가 있어서 임상시험 데이타가 쏟아져 나왔습니다. 특히 이전에 top-line 결과만 발표하고 수치를 제시하지 않았던 여러 임상시험들의 자세한 데이타들이 공개됐습니다. 아래는 ESMO에서 주목받은 임상시험 결과들입니다. 결과를 보실 때는 동일 적응증에 대해 결과를 발표한 회사들의 주가가 어떻게 움직였는지를 같이 보시면 좋을 것 같습니다. 이번 ESMO의 하이라이트는 GSK, AZN의 PARP 저해제들이 DNA 재조합회복 유전자 돌연변이가 없는 난소암에도 효과적이라는 점을 보여준 임상시험들과 Seattle Genetics의 방광암에 대한 항체-약물 접합체와 면역항암제 병용 임상시험이었던 것 같습니다.
[PARP 저해제 – 난소암 1차 유지 요법]
이번 ESMO에서 시작전부터 가장 주목받던 발표 중 하나가 Lynparza (AZN/MRK)와 Zejula (GSK)의 PARP 저해제에 대한 발표였습니다. 현재 PARP 저해제 시장은 Lynparza가 압도적으로 Zejula와 Rubraca (Clovis Oncology, CLVS)를 앞서나가고 있습니다 (2Q19 매출 Lynparza $283M, Zejular $63M, Rubraca $33M). 반면 GSK는 올해 초 $5.1B을 들여 Tesaro를 인수합병하면서 Zejula를 품에 넣고 AZN/MRK에 도전장을 내밀었습니다. Lynparza에 의해 주도된 기존의 PARP 저해제는 DNA 재조합 회복 시스템이 손상된 (Homologous Recombination Deficiency) 암들에 적용되어 왔는데, HRD를 지닌 난소암은 전체 난소암의 일부에 지나지 않고, HRD 검사를 하기 위해서는 추가적인 비용이 들기 때문에 이와 무관하게 전체 난소암 환자에 PARP 저해제를 투여할 수 있다면 시장성은 크게 확장되게 됩니다. GSK는 지난 7월 Zejula의 단독 투여가, AZN/MRK는 지난 8월 Lynparza/Avastin (Roche) 콤보가 각각 HRD 여부와 무관한 난소암 환자군에서 효능이 있다는 결과를 발표했습니다. 이번 ESMO에서 그 데이타가 처음 공개됐습니다.
GlaxoSmithKline (GSK): GSK는 플라티넘 화학치료를 받은 3기/4기 난소암의 1차 유지 치료에 대한 임상 3상 Prima의 Zejula 단독 요법의 중간 데이타를 발표했습니다. OS 데이타는 아직 미성숙 단계이고 PFS의 Hazard Ratio (HR)은 아래 표와 같습니다.
AstraZeneca (AZN), Merck (MRK), Roche (RHHBY): Lynparza, Avastin (Roche) 병용의 진행성 난소암 (advanced ovarian cancer) 1차 유지요법 (first line maintenance therapy)에 대한 임상 3상 PAOLA-1에서 표준 치료제인 Avastin 단독 치료 대비 primary endpoint인 PFS를 충족했습니다. mPFS는 Avastin 단독 투여군 16.6개월, 병용 투여군 22.1개월입니다. 전체 및 하위 환자군의 HR은 아래 표와 같습니다.

HR (Hazard Ratio)은 대조군 대비 어느 정도의 개선이 있는지를 보여주는 수치로 1인 경우 대조군과 동일하고 1보다 작아질 수록 더 좋습니다. 가령 OS가 투여군 40%, 대조군 30%라고 했을 때 투여군이 33%의 생존 혜택이 있다고 볼 수 있는데 이런 경우 HR은 0.67이 된다고 생각하시면 대략 맞습니다. 실제 계산 방법은 이보다는 훨씬 복잡합니다.
AbbVie (ABBV): 한편 AbbVie 역시 자사의 PARP 저해제 veliparib 단독요법의 난소암에 대한 임상 3상 결과를 발표했습니다. 관심 밖의 임상 시험이었지만 결과는 좋게 나왔습니다. 전반적으로 Lynparza + Avastin이나 Zejula 대비 조금 떨어지지만 통계적으로는 동일하다고 볼 수 있는 수치들인 mPFS 23.5개월 vs 17.3개월, HR 0.68, P<0.001을 보였고 각각의 특정 환자군 내의 수치 역시 유사했습니다. 차이점은 verliparib을 플라티넘 화학요법 이후에 유지요법으로 사용한 것이 아니라 플라티넘과 병용으로도 투여하고 이후에 유지요법으로 사용했다는 점입니다. 한편 Her2 음성, BRCA 양성 유방암에 대한 veliparib, 화학치료 병용 2차치료의 임상3상 Barcade-3의 결과 역시 발표됐는데, 플라시보 대비 mPFS 14.5개월 vs 12.6개월 HR 0.71 p=0.002, mOS 33.5개월 vs 28.2개월 HR 0.95 p=0.67, ORR 75.8% vs 71.1%로 그리 인상적이지 않은 효능을 보였습니다.
종합해보면 HRD 유무와 무관한 난소암 전체 환자군에 대해 Zejula 단독은 38%의 PFS 혜택, Avastin+Lynparza는 41%의 PFS 혜택을 보여주기 때문에 사실상 차이가 없다고 보여집니다. 나중에 OS 데이타가 어떻게 나올지는 모르겠지만 현재로서는 승자를 가늠하기 어려운데, 아무래도 병용보다는 단독 요법이 치료비상의 잇점이 있기 때문에 GSK의 판정승이 되지 않을까 싶습니다. 주가를 봐도 발표 후 GSK의 주가는 52주 신고가를 기록한 반면 AZN의 주가는 하락했습니다. 아직 FDA 승인을 받기 까지는 시간이 좀 더 걸리겠지만 임상시험 결과가 발표됐으니 의사들이 off label로 BRCA 돌연변이 유무와 무관하게 사용을 시작할 듯 하고 매출 추이에 어느정도 변화가 반영되지 않을까 싶습니다. Veliparib의 경우는 아직 첫 FDA 승인을 받기까지 갈길이 멀고 시장에 들어온다고 해도 Pfizer의 Talzenna에 이은 다섯번째 PARP 저해제인지라 시장성에 대한 의문도 있어서 좀 더 지켜봐야할 듯 합니다.
* PARP 저해제 작용기제 – PARP 효소는 DNA 이중나선 중 하나의 나선이 끊어지는 손상이 발생했을 때 이를 복구하는 메카니즘 (single-strand break repair, SSBR)에 관여합니다. DNA에 이중나선 모두가 끊어지는 손상이 발생하는 경우의 복구 메카니즘 (double-strand break repair, DSBR)인 상동 재조합 (Homologous Recombination, HR)이 망가지게 되는 경우 SSBR이 이를 불완전하지만 임시로나마 복구하는 작업을 맡게 됩니다. 세포는 끊어진 DNA를 적절히 복구시키지 못하면 세포 분열을 하면서 DNA를 잃어버리게 되고 결국 죽게 됩니다. 유방암, 난소암, 대장암 등 여러 종류의 암에 HR 시스템이 망가져있다는 점에 착안, SSBR에 관여하는 PARP를 저해하여 암세포 DNA 복구를 못하도록 막아 암세포가 죽도록 하는 것이 PARP 저해제의 작용 기제입니다.
AstraZeneca (AZN), Merck (MRK): AZN/MRK는 8월초 primary endpoint를 충족했다고 발표했던 Lynparza의 전립선암에 대한 임상 3상 PROfound의 데이타를 공개했습니다. 상동재조합 DNA 회복 유전자 돌연변이 (homologous recombination repair gene mutation, HRRm)를 지닌 호르몬 치료에 내성을 보이는 전이성 거세저항성 전립선암 (metastatic castration-resistant prostate cancer, mCRPC)에 대한 임상시험에서 Lynparza 투여군은 표준치료인 호르몬 치료 Zytiga (abiraterone, J&J) 혹은 Xtandi (enzalutamide, Pfizer/Astellas) 대비 primary endpoint인 BRCA1/2, 혹은 ATM 돌연변이를 지닌 코호트의 rPFS에서 7.4개월 vs 3.6개월, HR 0.34를 보였고, secondary endpoint인 전체 HRRm환자군의 rPFS는 5.8개월 vs 3.5개월, HR 0.49를 보였습니다. 또다른 secondary endpoint인 BRCA1/2, ATM 돌연변이 코호트의 ORR은 33.3% vs 2.3% 였습니다.
[CDK4/6 저해제 – HR 양성 HER2 음성 유방암]
CDK4/6 저해제는 HR 양성 HER2 음성 유방암 치료제 시장에서 경쟁중인데 Pfizer의 Ibrance가 2015년 첫 승인을 받았고, Novartis의 Kisqali, Eli Lilly의 Verzenio가 2017년에 승인을 받았습니다. 2019년 2분기 매출은 각각 $1.3B, $111M, $134M로 Ibrance가 압도하고 있습니다. Lilly와 Novartis는 Ibrance를 따라잡기 위해 Ibrance보다 효능이 좋다는 데이타를 만들기 위해 애쓰고 있네요.
Eli Lilly (LLY): 표준 호르몬 치료제 Fulvestrant 치료를 받은 HR양성 HER2 음성 유방암 2차 치료제로Verzenio를 사용한 임상 3상 Monarch 2 장기 추적결과 fulvestrant 만 투여한 환자군 대비 mOS 46.7개월 vs 37.3개월, HR 0.76, p=0.0137을 보였고 특히 fulvestrant 치료에 저항성을 보이는 환자들에서 HR 0.675를 보였습니다. 또한 치료후 후속 화학치료가 필요하기까지의 기간 중간값 50개월로 fulvestrant 투여군의 22개월을 크게 앞섰습니다.
Novartis (NVS): Novartis는 ESMO에서 임상 3상 Monaleesa-3의 OS결과를 발표했습니다. 발표에서 Kisqali는 폐경 후 여성의 HR 양성 HER2 음성 유방암에서 HR 0.724로 28% 증가된 생존율을 보였습니다.이는 Ibrance의 생존율에 매칭되는 결과입니다.
G1 Therapeutics (GTHX): G1의 리드 신약후보물질 trilaciclib은 위에 언급한 Ibrance/Kisqali/Verzenio와는 다른 종류의 CDK4/6 저해제입니다. Trilaciclib은 CDK4/6을 완전히 저해해서 분열하는 세포가 죽도록하는 다른 CDK4/6 저해제와는 달리 임시로만 저해제해서 정상세포 중 분열하는 세포인 줄기세포를 화학항암제로부터 보호해주는 역할을 합니다. G1은 많은 암환자들에게 CDK4/6 저해제가 듣지 않는다는 데에서 착안해서 CDK4/6 저해제를 기존과는 다른 용도인 화학항암제의 보조요법으로 사용하도록 개발중입니다. G1은 지난 6월 trilaciclib과 현 표준치료인 화학항암제 gemcitabine/carboplatin (GC) 병용을 투여한 전이성 삼중음성 유방암 (metastatic triple-negative breast cancer, mTNBC)에 대한 임상 2상에서 화학항암제만 사용한 그룹의 OS대비 큰 차이를 보인다고 발표한 바 있는데 이번 ESMO에서 그 수치를 공개했습니다. 화학항암제 GC만 투여한 환자군의 OS 12.6개월 대비 두개의 trilaciclib 투여스케쥴 + GC 환자군에서는 20.1개월 (HR 0.33, p=0.0283)과 17.8개월(HR 0.34, p=0.0023)의 OS를 보였습니다. 하지만 이전에 이미 공개된데로 원래 의도했던 primary endpoint인 myelopreservation (골수 보호 효과)는 충족하지 못했고, secondary endpoint인 PFS 역시 충족하지 못했습니다. 발표 후 주가가 30% 하락했는데 이유가 골수 보호효과가 없기 때문으로 보기에는 이미 이전에 공개했던 내용이라 좀 불충분해 보이고, 지난 5월 PD-L1 양성 삼중음성 유방암에 대해 FDA 승인을 받은 Tecentriq + Abraxane 병용의 결과와 대비된 것이 아닌가 하는 추측입니다. 당시 승인을 이끈 IMpassion130의 결과는 Abraxane 단독용법 대비 mPFS 7.4개월 vs 4.8개월, HR 0.6 p<0.0001, mOS의 경우 통계적 유의미성 획득에는 실패했지만 25개월 vs 15.5개월, HR 0.84를 보였습니다.
[암의 발생 기관과 무관하게 (tissue agnostic) 특정 돌연변이를 타게팅하는 항암제]
Zymeworks Inc. (ZYME): 이중항체 개발사 Zymeworks의 리드 후보물질 ZW25의 여러 임상시험 데이타들이 ESMO에서 발표됐습니다. ZW25는 HER2의 서로 다른 부위에 결합하는 이중항체로 다양한 HER2 양성 고형암들 – 담도암 (biliary tract cancer, BTC), 대장암 (colorectal cancer, CRC), 부인과 암 (유방암, 난소암 등gynecological cancers), 위식도선암 (gastroesophageal adenocarcinoma, GEA)에 대해 단독 혹은 병용으로 임상 1, 2상을 진행중입니다. ESMO에서는 유방암을 제외한 58명의 HER2 양성 고형암 환자들에 대한 결과가 발표됐는데 (23 GEA, 13 CRC, 9 BTC, 13 기타) 46명의 평가 가능한 환자들 중 ORR/PR 37% (17/46), SD 35% (16/46), DCR 72% (33/46)을 보였습니다. 암별 ORR은 BTC 67% (4/6), CRC 36% (4/11), GEA 32% (6/19)를 보였고 mPFS는 5.2개월이었습니다.
Amgen (AMGN), Mirati Therapeutics (MRTX): Amgen이 9월초 폐암 학회에 이어 AMG 510 (KRAS G12C 저해제)의 폐암 이외의 고형암의 업데이트된 데이타를 ESMO에서 발표했는데 폐암 결과에 비해 다소 실망스러운 결과였습니다. 임상 2상의 농도로 기대를 모았던 고용량 960 mg 복용 대장암 환자군에서 1명의 PR만이 나와 8% (1/12)라는 낮은 ORR을 보였습니다. 이 수치는 지난 봄 ASCO에서 발표했던 10명중 2명의 PR (ORR 20%)에서 도리어 감소한 수치로 한명의 PR 환자가 재발했습니다. 12명중 10명이 SD라 DCR이 92%로 높게 나온점은 그나마 위안거리입니다. 동일한 KRAS G12C를 타게팅하는 Mirati Therapeutics의 MRTX849는 올해 말 발표 예정인데 10/26~29 기간에 보스톤에서 개최되는 AACR-NCI-EORTC triple meeting에서의 발표가 유력하다고 합니다. 발표 후 Amgen의 주가는 큰 영향이 없어던 반면 Mirati의 주가가 8% 하락했습니다.
Eli Lilly (LLY): Lilly가 Selpercatinib (LOXO-292)의 임상 1/2상 LIBRETTO-001의 갑상선암 데이타를 ESMO에서 발표했습니다. LIBRETTO-001의 폐암 데이타는 지난 9월초 폐암학회에서 발표한 바 있습니다. Selpercatinib은 $8B에 Loxo Oncology를 인수하면서 가져온 RET 저해제로 RET 융합 돌연변이를 지닌 암들에 대해 암의 발생 기관과 무관하게 (tissue agnostic) 임상시험을 진행중입니다. 이번 발표에서 selpercatinib 은 표준치료제인 cabometyx (EXEL) 혹은 caprelsa (SNY) 등의 TKI 치료를 받은적 있는 환자군에서 ORR 68%, 1차 치료제로는 ORR 59%, RET 융합 단백질을 지닌 환자군에서는 ORR 62%을 기록했습니다. mPFS는 11개월 컷오프에서 아직 미치지 못했지만 cabometyx의 PFS가 11.2개월이라 이보다 길어질 것으로 보입니다.
[방광암, 요로상피세포 암 (urothelial bladder cancer)]
Astellas (OTC:ALPMY), Seattle Genetics (SGEN), Merck (MRK): 항체 약물 접합체 (antibody-drug conjugate, ADC) enfortumab vedotin (anti-Nectin-4)과 Keytruda (anti-PD1)병용의 진행성 요로상피세포암 (advanced urothelial cancer) 1차 치료제에 대한 임상 1상에서 ORR 71%, CR 13%, DCR 93%의 효능을 보였습니다 (n=45). 1차 치료제인 화학치료제 cisplatin 치료를 진행하기 어려운 환자들을 대상으로 한 이번 임상시험에서 1명의 환자가 치료로 인한 합병증으로 사망했고 절반 이상의 환자에서 부작용이 나타났지만 임상시험을 중단한 환자는 4명 (9%)였습니다. Cisplatin 화학치료가 불가능한 PD-L1 양성 요로상피세포암에 대해 단독 치료로 승인을 받은 Keytruda의 승인시 ORR은 47%, CR 15%였습니다. Astellas와 Seattle Genetics는 지난 6월 ASCO에서 화학항암제 및 면역항암제가 실패한 요로상피세포암 환자들을 대상으로 한 enfortumab vedotin 단독요법의 임상2상에서 ORR 44%, CR12%의 결과로 FDA에 승인신청을 한 상태이고 PDUFA는 2020년 3월 15일입니다.
Immunomedics (IMMU): Seattle Genetics와 마찬가지로 ADC를 개발하는 Immunomedics가 리드신약후보인 Sacituzumab govitecan의 Trophy-U-01 ORR 29% (10/35), CR 5.7% (2/35)
Seattle looks set to have the last laugh, having remarkably tried and failed to license sacituzumab from Immunomedics back in 2017.
Roche (RHHBY): 지난 8월 primary endpoint를 충족했다고 발표했던 Tecentriq (anti-PD-L1)과 화학치료 병용의 방광암/요로상피세포암 1차 치료에 대한 임상 3상 (IMvigor130)의 데이타가 발표됐습니다. Tecentriq + 화학치료제 (A), Tecentriq 단독 (B), 화학치료제 (C) 세개의 그룹으로 나눠서 진행된 임상시험에서 Tecentriq 단독 그룹은 화학치료 대비 PFS, OS 모두 우월성 입증에 실패했습니다. 반면 Tecentriq + 화학치료제 그룹 (A)은 화학치료 단독 (C) 대비 mPFS 8.2개월 vs 6.3개월, HR 0.82 (p=0.007)로 우월성을 보였고, OS의 경우 통계적 유의미성은 획득하지 못했지만 수치상 16개월 vs 13.4개월, HR=0.83으로 우월성을 보였습니다. 이번 임상시험은 PD-L1 발현 여부와 무관하게 진행됐습니다. 현재 Tecentriq은 PD-L1이 5% 이상 발현되는 방광암/요로상피세포암의 1차 와 2차 치료제로 FDA 승인을 받은 상태입니다.
[담관암 bile duct cancer/cholangiocarcinoma]
Incyte (INCY): FGFR 저해제 pemigatinib의 진행성/전이성 담관암 (advanced/metastatic cholangiocarcinoma) 2차 치료에 대한 임상 2상 FIGHT-202에서 치료 효과 입증에 성공했습니다. FGFR2 유전자의 융합 혹은 재배열이 발생한 담관암 환자군에서 primary endpoint인 ORR 36% (n=38/107, 3 CR + 35 PR)과 DCR 82% (n=88/107)을 보였습니다. Secondary endpoint인 중간 반응 기간 (median duration of response)는 7.5개월, mPFS는 6.9개월이고 잠정 mOS는 21.1개월입니다. 이번 임상 2상은 대조군 없는 single arm study였고, Incyte는 임상 3상 없이 올해 안에 FDA에 승인 신청을 할 계획입니다.
Agios (AGIO): Agios 역시 Tibsovo (IDH1 저해제)의 담관암(cholangiocarcinoma)에 대한 임상 2상 Claridhy의 결과를 발표했습니다. IDH1 돌연변이를 지닌 2차, 3차 치료 환자들에 대한 이번 임상시험에서 primary endpoint인 PFS의 HR은 0.37 (p<0.001)로 63% 진행율 감소를 보이며 효능을 입증했습니다. 그러나 mPFS의 경우 수치적으로는 2.7개월로 플라시보의 1.4개월보다 겨울 1.3개월 길어졌고, mOS는 10.8개월로 플라시보의 9.7개월 대비 통계적 유의미성 획득에 실패했습니다. Agios 역시 임상 3상 없이 이번 결과를 올해 안에 FDA 승인 신청을 할 예정입니다. 서로 다른 돌연변이를 지닌 환자군에 대한 임상시험이고 Incyte의 임상시험은 대조군이 없는 임상시험이라 두를 비교하는 것은 공정하지 않지만 어쩔수없이 둘이 대조가 되면서 Agios의 주가는 하락했습니다.
[면역관문 억제제 (Cancer Immune Checkpoint Therapy)]
Roche (RHHBY), Exelixis (EXEL): Tecentriq (anti-PD-L1, RHHBY), Cotellic (MEK 저해제, EXEL) 병용의 흑색종에 대한 임상 3상 IMspire170에서 대조군으로 사용된 Keytruda 투여군 대비 ORR, PFS, 부작용 등 모든 측정치에서 열등한 결과를 보이며 실패했습니다. 각각의 수치를 보면 ORR 26% vs 32%, mPFS 5.5개월 vs 5.7개월, 3등급 이상 부작용 67% vs 33%, 부작용으로 인한 임상시험 중단율 12% vs 6%입니다. Tecentriq, Cotellic 병용은 Stivarga (Bayer)를 대조군으로 사용한 대장암 임상시험 IMblaze370에서 역시 실패한 바 있습니다. Roche는 Tecentriq, Cotellic 병용에 BRAF 저해제 Zelboraf를 더한 3중 병용으로 흑색종에 대한 임상 3상 IMspire150을 진행중이고 올해 말 결과 발표 예정입니다.
Merck (MRK), Eisai (ESALY): 2주전 FDA의 파일럿 프로그램인 Orbis 프로젝트하에서 미국, 호주, 캐나다의 첫 동시 승인을 받은 자궁 내막 종양 (advanced endometrial carcinoma that is not microsatellite instability-high (MSI-H) or mismatch repair deficient (dMMR) and whose cancer has progressed following prior systemic therapy but are not candidates for curative surgery or radiation)에 대한 Keytruda (MRK), Lenvima (Eisai, VEGFR 저해제) 병용 치료제의 데이타가 ESMO에서 발표됐습니다. 임상 2상 데이타에서 병용 치료제는 ORR 38.9%, CR 7.4%, mPFS 21.2개월을 보였습니다.
Bristol-Myers Squibb (BMY): Opdivo, 화학치료 병용의 식도암 (unresectable advanced or recurrent esophageal squamous cell carcinoma, ESCC)에 대한 임상 3상 ATTRACTION-3에서 화학치료 단독 대비 12개월 및 18개월 OS 비율 각각 47% vs 34%, 31% vs 21%, HR 0.77, OS 10.9개월 vs 8.4개월을 보였습니다. ORR은 19% vs 22%로 차이를 보이지 않았습니다.
[기타]
Seattle Genetics, Inc. (SGEN): ADC 전문 회사인 Seattle Genetics에서 유일하게 small molecule 신약후보인 Tucatinib (HER2 저해제)의 화학항암제 및 VEGF 항체에 내성을 보이는 전이성 대장암 (mCRC)에 대한 임상 2상 MOUNTAINEER의 결과 발표가 있었습니다. 또다른 HER2 저해제인 HER2 항체 Herceptin과 Tucatinib 병용은 ORR 55%, mPFS 6.2개월, OS 17.3 개월의 효능을 보였습니다 (n=22). Primary endpoint를 충족하기 위해서는 ORR 40%를 넘어야 합니다. Tucatinib은 Pfizer에 인수된 Array Biopharma 로부터 Cascadian이 라이센스-인 한 물질로 2018년 Seattle Genetics가 Cascadian을 $614M에 인수하면서 Seattle Genetics의 포트폴리오에 편입됐습니다.
Pfizer (PFE): Pfizer가 올해 초 Array Biopharma를 인수하면서 가져온 BRAFTOVI (encorafenib), MEKTOVI (binimetinib)와 Erbitux (cetuximab,anti-EGFR) 삼중병용의 BRAFV600E 돌연변이를 지닌 진행성/전이성 대장암 (advanced BRAFV600E-mutant metastatic colorectal cancer, mCRC) 2차 이상 치료 임상 3상 BEACON CRC의 업데이트 결과를 발표했습니다. 이번에 발표한 대장암 파이프라인이 Array를 $11.4B을 주고 인수한 주 요인이었습니다. 표준 치료인 Erbitux, irinotecan (화학치료) 병용 대비 mOS 9개월 vs 5.4개월, ORR 26% vs 2%의 효능을 보였습니다. 이 결과는 Amgen의 AMG 510 대장암 결과와 비교해서 보셔도 좋을 것 같습니다.
[액체 생검 (Liquid Biopsy)]
죽은 암세포로부터 혈액으로 방출되 돌아다니는 DNA를 시퀀싱 등의 방법을 통해 분석해내는 액체생검은 현재 암의 진행 경과를 보고 치료 옵션을 정하기위한 용도로는 사용되고 있지만 암 발생 전 조기진단을 위한 용도는 훨씬 어려워서 아직 개발에 성공한 회사는 없습니다. 현재 액체 생검 분야는 Illumina에서 스핀오프된 Grail (비상장), Guardant Health (GH), Roche에 인수된 Foundation Medicine, Thrive 등이 경쟁중입니다.
Grail: 지난 6월 ASCO에서 Grail은 혈액 검사인 액체 생검을 통해 12개의 암을 한번에 진단하고자 개발중인 테스트의 결과를 공개했습니다. 이번 ESMO에서는 그 테스트가 20종 이상의 암과 질병의 하위 유형 및 발생 기관까지 진단해 낼 수 있다는 결과를 공개했습니다. Grail의 Circulating Cell-free Genome Atlas Study, STRIVE 두 스터디의 3,580개의 혈액 샘플 데이타를 분석한 결과 99.4%의 특이성 (specificity)와 0.6%의 위양성율 (false-positive rate), 76%의 민감도 (sensitivity)를 보였습니다. 암의 단계별로는 1기~4기 암 각각의 예측도는 32%, 76%, 85%, 93%로 암의 경과가 많이 진행될 수록 예측도가 상승했습니다. 더불어 97%의 샘플에서 암의 최초 발생 기관을 특정하는데 성공했고 89%의 케이스에서 암의 위치를 특정하는데 성공했습니다. Grail은 Illumina에서 스핀오프한 회사이고 아직 비상장입니다.
Roche (RHHBY): 2018년 Roche에 인수된 Foundation Medicine의 액체생검 테스트 Foundation One Liquid가 ALK양성 비소세포 폐암 (Alk-positive NSCLC) 진단에 조직생검보다 효과적일 수 있다는 결과가 나왔습니다. 2017년 ALK 양성 비소세포 폐암에 대해 FDA 승인을 받은 Roche의 Alecensa의 임상시험에 Foundation One Liquid 액체생검 테스트를 이용한 The Bfast 임상시험에서의 효능이 Alecensa가 FDA승인을 받을 때의 효능보다 높게 나왔습니다. FDA 승인을 받을 당시에는 Roche의 Ventana Alk (D5F3) CDx Assay 조직생검 테스트를 사용했습니다. 구체적으로는 ORR 87% vs 79%, 뇌 전이에 대한 ORR 91% vs 81% 입니다.
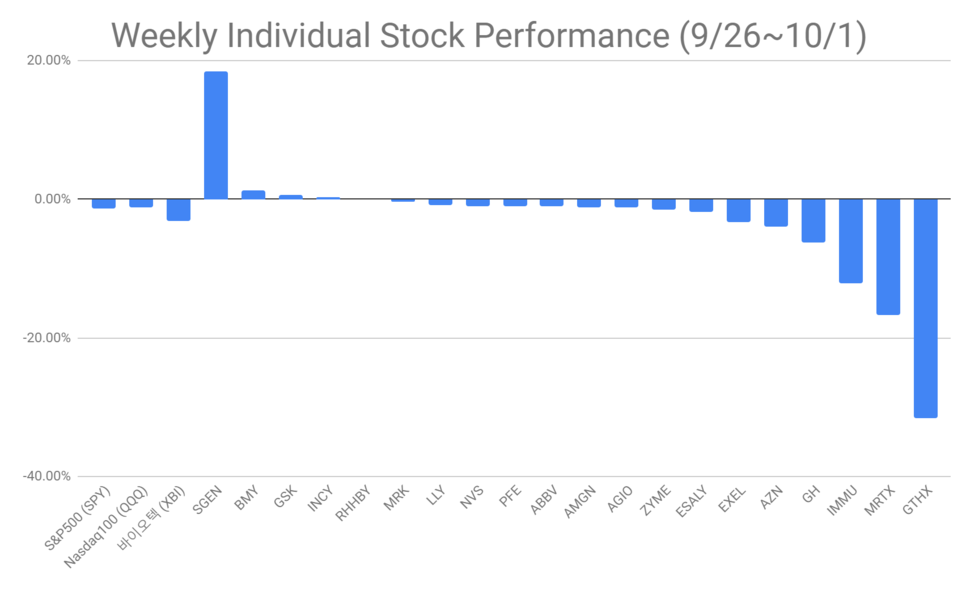
아래 그림은 ESMO 시작 하루전인 9/26부터 종료일인 10/1까지 사이의 주가 움직임입니다.
'Archive > 학회정리' 카테고리의 다른 글
| ASCO 2018 Day 1 & Day 2 : 네이버 블로그 (2018/6/4) (0) | 2020.01.14 |
|---|---|
| ASH 2019 정리 (2019-12-11) (0) | 2019.12.16 |
| ASCO 2019 정리 (2019-6-6) (0) | 2019.12.16 |
